Спирти — похідні вуглеводнів, молекули яких містять одну або кілька гідроксильних груп.
Класифікація. Спирти класифікують за кількома ознаками.
За кількістю гідроксильних груп у молекулі спирти поділяють на одноатомні (молекула містить одну групу –ОН) і багатоатомні — двохатомні (дві групи –ОН), трьохатомні (три групи –ОН) та ін. Загальна формула одноатомних спиртів — R–ОН.
Гідроксильні групи в молекулах багатоатомних спиртів з’єднані з різними атомами Карбону (сполуки, в молекулах яких атом Карбону з'єднаний із двома або трьома ОН-групами, нестійкі або не існують):
СН2ОН-СН2ОН, СН2ОН-СНОН-СН2ОН.
Зважаючи на особливості зв’язків між атомами Карбону в молекулах, розрізняють насичені, ненасичені, ароматичні спирти. Приклади формул одноатомних спиртів кожної групи:
СН3–СН2ОН, СН2=СН–СН2ОН, С6Н5–СН2ОН.
Гідроксильна група може сполучатися з первинним, вторинним або третинним атомом Карбону. За відповідною ознакою одноатомні спирти поділяють на первинні, вторинні й третинні.
Спирти, молекули яких містять 10 і більше атомів Карбону, називають вищими.
Насичені спирти. Ці сполуки є похідними вуглеводнів СnH2n+2, у молекулах
яких один або кілька атомів Гідрогену заміщені на гідроксильні групи. Загальна формула насичених одноатомних спиртів — СnH2n+1OH.
Назви. Систематична назва насиченого одноатомного спирту складається з назви відповідного алкану і суфікса -ол: СН3ОН — метанол, С2Н5ОН — етанол.
Якщо молекула спирту містить три або більше атомів Карбону, то їх нумерують з того кінця ланцюга, до якого ближче розташована ОН-група. У назві такого спирту перед суфіксом -ол указують номер атома Карбону, з яким сполучена гідроксильна група:
3 2 1
СН3–СН2–СН2ОН
пропан-1-ол.
Місце характеристичної групи в назві спирту раніше вказували так: 1-пропанол, пропанол-1.
У розгалуженій молекулі спирту обирають найдовший карбоновий ланцюг, причому такий, щоб один із його атомів був сполучений із гідроксильною групою. Назви замісників та їх положення додають до назви спирту за правилами, встановленими для вуглеводнів:
2,3-диметилбутан-1-ол
На практиці часто використовують інші назви спиртів. Кожна з них складається із двох слів. Перше слово походить від назви вуглеводневого залишку, з яким сполучена гідроксильна група, а другим є слово спирт:
СН3ОН — метиловий спирт, С2Н5ОН — етиловий спирт.
Цікаво знати: тривіальна назва метанолу — деревний спирт, а етанолу — винний спирт.
Найпростіші багатоатомні спирти мають такі тривіальні назви:
СН2ОН–СН2ОН — етиленгліколь;
СН2ОН–СНОН–СН2ОН — гліцерол, гліцерин.
Ізомерія. Cтруктурна ізомерія спиртів зумовлена різним положенням гідроксильних груп у молекулах і різною будовою карбонового ланцюга. Cтруктурні формули молекул ізомерних спиртів С4Н9ОН:
Для спиртів відомі ізомери, які належать до інших класів сполук. Наприклад, ізомером етанолу С2Н5ОН є диметиловий етер СН3–О–СН3. Такі ізомери називають міжкласовими.
Етери — органічні речовини, в молекулах яких атом Оксигену сполучений із двома вуглеводневими залишками R1–О–R2. Раніше ці речовини називали простими ефірами.
Розв’язування задач. Розглянемо, як розв’язують задачі на виведення хімічних формул спиртів. Запропоновані способи розв’язання задач можна використовувати і для оксигеновмісних органічних сполук інших класів.
ЗАДАЧА 1. Вивести хімічну формулу насиченого одноатомного спирту, якщо його молярна маса становить 46 г/моль.
Дано:
М(СnH2n+1ОН) = 46 г/моль
СnH2n+1ОН — ?
Розв’язання:
1. Записуємо загальний вираз для молярної маси насиченого одноатомного спирту: М(СnH2n+1ОН) = n•М(С) + (2n + 1)•М(H) + М(ОH) =
= 12n + 2n + 1 + 17 = 14n + 18 (г/моль).
2. Знаходимо хімічну формулу сполуки:
14n + 18 = 46; n = 2.
Формула спирту — С2Н5ОН.
Відповідь: С2Н5ОН.
ЗАДАЧА 2. Вивести формулу спирту, якщо при спалюванні 0,48 г цієї сполуки утворилося 0,336 л (н. у.) вуглекислого газу та 0,54 г води.
Дано:
m(спирту) = 0,48 г
V(СО2) = 0,336 л (н. у.)
m(Н2О) = 0,54 г
CxHyOz — ?
Розв’язання:
1. Записуємо схему реакції:
CxHyOz + O2 → CO2 + H2O.
2. Обчислюємо кількості речовини Карбону і Гідрогену, атоми яких при згорянні спирту «перейшли» в молекули вуглекислого газу і води:
ʋ(C)=ʋ(CO2)=V(CO2) : Vm= 0,336 : 22,4 = 0,015 (моль);
ʋ(H)=2ʋ(H2O)=2*m(H2O): M(H2O)= 0,54 : 18 = 0,06 (моль).
3. Знаходимо сумарну масу Карбону і Гідрогену:
m(С) = ʋ (С)•М(С) = 0,015 моль• 12 г/моль = 0,18 г;
m(Н) = ʋ (Н)•М(Н) = 0,06 моль•1 г/моль = 0,06 г;
m(С) + m(Н) = 0,18 г + 0,06 г = 0,24 г.
4. Обчислюємо масу і кількість речовини Оксигену в спирті:
m(О) = m(спирту) – (m(С) + m(Н)) = 0,48 – 0,24 = 0,24 (г);
ʋ (O) = m(O) : M(O) = 0,24 : 16 = 0,015 (моль).
5. Знаходимо співвідношення індексів у формулі спирту:
x : y : z = ʋ(С) : ʋ(Н) : ʋ(О) = 0,015 : 0,06 : 0,015 = 1 : 4 : 1.
Формула сполуки — СН4О, або СН3ОН.
Відповідь: СН3ОН.
Будова молекул. Молекула будь-якого одноатомного спирту складається із двох частин — вуглеводневого залишку і гідроксильної групи. Атом Оксигену, найбільш електронегативного елемента в молекулі, зміщує у свій бік спільні електронні пари від атомів Карбону і Гідрогену. Тому зв’язки С–О та О–Н є полярними (останній зв’язок більш полярний):
Існування полярних зв’язків у молекулах спиртів значною мірою зумовлює характерні реакції цих сполук.
Зі зростанням карбонового ланцюга в молекулах спиртів полярність зв’язку О–Н зменшується. У молекулі первинного спирту цей зв’язок більш полярний, ніж у молекулі вторинного або третинного спирту.
Фрагмент молекули спирту С–О–Н є кутовим, як і молекула води. На атомі
Оксигену зосереджений невеликий негативний заряд, менший за одиницю, а з протилежного боку молекули, де перебувають атоми Гідрогену, — позитивний заряд. Тому молекула спирту полярна.
Фізичні властивості. Наявність у молекулах спиртів гідроксильних груп суттєво впливає на фізичні властивості цих сполук.
Атоми Гідрогену й Оксигену ОН-груп беруть участь в утворенні водневих зв’язків між молекулами спирту. Тому серед спиртів немає газоподібних речовин (відмінність від вуглеводнів), а їх температури кипіння значно вищі, ніж відповідних алканів. Одноатомні спирти з невеликою кількістю атомів Карбону в молекулах за звичайних умов є безбарвними рідинами зі специфічним запахом (спиртовим, камфорним, сивушним).
Вищі спирти — тверді речовини, які майже не мають запаху.
Метанол, етанол, а також пропаноли і метилпропан-2-ол необмежено розчиняються у воді внаслідок утворення водневих зв’язків між молекулами спирту і води. Розчинність інших спиртів зі збільшенням кількості атомів Карбону в молекулах зменшується, а вищі спирти у воді нерозчинні.
Хімічні властивості. Реакції за участю спиртів відрізняються від тих, у які вступають вуглеводні.
Реакції з металами. Спирти взаємодіють із лужними металами з виділенням водню й утворенням солеподібних сполук:
2С2Н5ОН + 2Na → 2С2Н5ОNa + Н2↑.
етанол натрій етанолят (натрій етилат)
При цьому полярні зв’язки О–Н у молекулах спирту розриваються, і атоми Гідрогену заміщуються на атоми металічного елемента. У таких реакціях спирти поводяться як кислоти. Однак вони не дисоціюють з утворенням йонів Н+, не реагують із лугами; спирти — неелектроліти.
Дегідратація. Вам уже відомо, що так називають реакцію відщеплення води від будь-якої сполуки. Умови її перебігу для спиртів — нагрівання й наявність концентрованої сульфатної кислоти. Відщеплення молекули води може відбуватися від однієї (t0=1700C) або двох (t0<1400C) молекул спирту. У першому випадку при дегідратації одноатомного спирту, крім води, утворюється алкен (внутрішньомолекулярна дегідратація), а в другому випадку — етер (міжмолекулярна дегідратація):
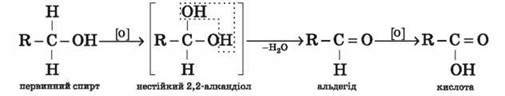
Окиснення. Первинні спирти за дії окисників перетворюються на альдегіди, які окиснюються до карбонових кислот (відповідні реакції називають частковим окисненням):
Окиснення етилового спирту використовують у виробництві харчової оцтової кислоти.
Легко помітити, що суть окиснення органічної сполуки може полягати у зменшенні кількості атомів Гідрогену в її молекулі (С2Н5ОН → С2Н4О) або збільшенні кількості атомів Оксигену (С2Н4О → С2Н4О2).
альдегід кислота
Спирти окиснюються калій перманганатом, купрум(ІІ) оксидом. Щоб здійснити другу реакцію, мідну пластинку нагрівають до її потемніння (на поверхні металу утворюється оксид CuO) й гарячою занурюють в етанол. Пластинка знову стає блискучою, і з’являється запах, властивий оцтовому альдегіду:
С2Н5ОН + CuO → СН3СНО +Cu+ Н2O.
Повне окиснення спирту відбувається, якщо його підпалити. Метиловий і етиловий спирти горять на повітрі майже безбарвним полум’ям, а вищі спирти — кіптявим.
Реакції з галогеноводнями. Спирти взаємодіють із хлороводнем, бромоводнем, йодоводнем. При цьому гідроксильна група в молекулі спирту заміщується на атом галогену:
С2Н5ОН+НCl= С2Н5Cl+Н2О
хлороетан
(реакція проводиться за допомогою реактиву Лукаса – НCl+ ZnCl2).
Добування спиртів. Найважливішими в практичному відношенні є метиловий і етиловий спирти. Їх добувають у промисловості в найбільшій кількості.
Сучасний метод добування етилового спирту ґрунтується на реакції етену з водяною парою за температури 300 °С, підвищеного тиску і наявності каталізатора:
t, p, k
СН2=СН2 + Н2О ⎯⎯→ CH3–CH2OH.
Основою іншого методу є спиртове бродіння глюкози у водному розчині за участю ферментів (лат. fermentum — закваска — білки, що виконують роль каталізаторів) дріжджів:
ферменти
С6Н12О6 ⎯⎯⎯⎯→ 2С2Н5ОН + 2СО2↑.
Цей біохімічний процес використовують із давніх часів для виготовлення вина з винограду, інших ягід і фруктів.
Вихідною речовиною у виробництві спирту для потреб харчової промисловості є пшеничний або картопляний крохмаль, а технічного спирту — целюлоза, добута з відходів переробки деревини.
Сировиною для виробництва метилового спирту є синтез-газ — суміш карбон(II) оксиду і водню, яку добувають взаємодією метану з водяною парою за високої температури і наявності каталізатора:
t, k
СН4 + Н2О (пара)= СО + 3Н2.
Утворення спирту відбувається в суміші газів згідно з рівнянням:
t, p, k
СО + 2Н2 = CH3OH.
Цей процес часто називають синтезом метанолу.
Застосування. Рідкі спирти використовують як розчинники, а також в органічному синтезі. Найбільшого застосування набули етиловий і метиловий спирти. Етанол використовують у медицині, фармакології, парфумерії, харчовій промисловості, іноді — як компонент пального для автотранспорту, а метанол — як сировину для хімічної промисловості.
Заводи переважно випускають етиловий спирт, що містить невелику кількість води (w(H2O) ≈ 4 %). Його назва — спирт-ректифікат.
Фізіологічна дія спиртів. Етиловий спирт є наркотичною речовиною, яка швидко всмоктується у кров. Людина в стані алкогольного сп’яніння поводиться неприродно, перестає контролювати свої дії, втрачає пам’ять, у неї порушується координація рухів. Постійне й надмірне вживання спиртних напоїв спричиняє алкоголізм. Ця хвороба вражає нервову, серцево-судинну, репродуктивну системи, руйнує печінку, призводить до зниження імунітету, розумових здібностей, інтелекту; людина деградує як особистість.
Метанол є сильною отрутою. При потраплянні в організм незначної кількості цієї сполуки людина повністю втрачає зір, а при більшій кількості — гине.
Багатоатомні спирти.
Найпростішим двохатомним спиртом є етиленгліколь НО–СН2–СН2–ОН, а трьохатомним спиртом — гліцерол, або гліцерин НОСН2–СНОН–СН2ОН. У природі цих спиртів немає, але похідні гліцеролу — жири — дуже поширені.
Фізичні властивості гліцеролу. Трьохатомний спирт гліцерол — безбарвна в’язка рідина, солодка на смак. Ця сполука не має запаху, гігроскопічна, трохи важча за воду, змішується з нею в будь-яких співвідношеннях з утворенням розчину.
Цікаво знати: в’язкість гліцеролу за звичайних умов у тисячу разів більша, ніж води.
Гліцерол кипить, розкладаючись, за температури +290°С, тоді як температури кипіння одноатомних спиртів (пропанолів) із такою самою кількістю атомів Карбону в молекулах значно нижчі. Відмінності зумовлені тим, що в багатоатомному спирті утворюється більше водневих зв’язків (кожна молекула гліцеролу містить три ОН-групи).
Хімічні властивості. Гліцерол взаємодіє не лише з активними металами, а й із деякими гідроксидами металічних елементів, зокрема з купрум(ІІ) гідроксидом. Цим він більше, ніж одноатомні спирти, нагадує кислоту. Однак гліцерол і його розчин не змінюють забарвлення індикаторів.
Реакції з металами. Під час взаємодії гліцеролу з лужними металами відбувається послідовне заміщення атомів Гідрогену в гідроксильних групах на атоми металічного елемента. Запис рівняння реакції цього спирту з надлишком натрію:
2С3Н5(ОН)3 + 6Na → 2С3Н5(ОNa)3 + 3Н2↑.
Щоб така реакція відбувалася з достатньою швидкістю, гліцерол нагрівають.
Сполуки металічних елементів, що є похідними гліцеролу, називають гліцератами.
Реакція з купрум(ІІ) гідроксидом. Якщо до щойно добутого за реакцією обміну осаду купрум(II) гідроксиду додати водний розчин гліцеролу, то осад розчиняється, а рідина набуває яскраво-синього кольору. Назва продукту взаємодії — купрум(ІІ) гліцерат. Ця реакція є якісною на багатоатомні спирти (на фрагмент молекули –СНОН–СНОН–).
Окиснення. Гліцерол горить на повітрі з утворенням вуглекислого газу і води. Щоб провести такий дослід, невелику кількість спирту нагрівають у порцеляновій чашці й підпалюють за допомогою скіпки. Сполука горить майже безбарвним полум’ям.
Добування і застосування. Гліцерол добувають у промисловості різними методами. Традиційний метод ґрунтується на гідролізі жирів.
Гліцерол для технічних потреб синтезують із пропену.
Значні кількості гліцеролу використовують у виробництві вибухових речовин. Цю сполуку також застосовують для пом’якшення шкіри при виготовленні взуття та одягу.
Гліцерол є компонентом зубних паст, мила, косметичних кремів. Іноді його добавляють у лікери для надання їм в’язкості.
Водні розчини двохатомного спирту етиленгліколю застосовують узимку для охолодження двигунів в автомобілях. Назва цих рідин — антифризи. Термін походить від англійського слова freeze — замерзати. Антифризи не замерзають за низьких температур. Водіям слід пам’ятати, що етиленгліколь дуже токсичний.
Феноли – органічні сполуки, у яких гідроксильна група безпосередньо зв’язана з бензеновим ядром.
Найпростішою сполукою цього класу речовин є фенол С6Н5ОН. Його можна розглядати як похідну бензену, в молекулі якого один з атомів Гідрогену заміщений на гідроксильну групу:
Зверніть увагу! Фенол не зараховують до класу спиртів, оскільки гідроксильна група в його молекулі безпосередньо сполучена з бензеновим кільцем.
Будова молекули. Наявність бензенового кільця в молекулі фенолу С6Н5ОН зумовлює більшу рухливість атома Гідрогену в ОН-групі, ніж у молекулах одноатомних спиртів ROH. Якщо в молекулі спирту вуглеводневий замісник віддає частину своєї електронної густини атому Оксигену (СН3→ОН), що призводить до зменшення полярності зв’язку О–Н, то в молекулі фенолу навпаки — атом Оксигену «збагачує» електронною густиною бензенове кільце. Неподілена пара р-електронів атома Оксигену, «втягуючись» у кільце, утворює з р-електронами атомів Карбону спільну електронну систему. Довжина зв’язку С–О зменшується, і він стає міцнішим.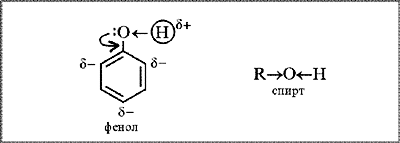
Атом Оксигену, компенсуючи втрату електронної густини, сильніше зміщує у свій бік спільну з атомом Гідрогену електронну пару (С6Н5–О←Н). Полярність зв’язку О–Н зростає; атом Гідрогену в молекулі фенолу набуває більшого позитивного заряду, ніж у молекулі спирту, стає рухливішим, а тому легше заміщується на інші атоми під час хімічних реакцій.
Гідроксильна група також впливає і на бензенове кільце. Вона спричиняє підвищену рухливість атомів Гідрогену бензенового кільця біля двох найближчих і найвіддаленішого атомів Карбону, де зосереджується найбільша електронна густина. Відповідні позиції в молекулі фенолу називають орто- і пара-положеннями.
Фізичні властивості фенолу. Фенол — безбарвна кристалічна речовина з різьким характерним запахом. 
У разі зберігання в нещільно закритому посуді поступово окиснюється і набуває рожевого кольору (t°пл=43°С, t°кип=182°С).
У холодній воді фенол розчиняється погано. Але якщо додати у пробірку з фенолом гарячої води, спостерігатиметься його швидке розчинення. Фенол має виражені антисептичні властивості, його водний розчин використовують для знезараження приміщень, хірургічного інструменту. Фенол токсичний. Потрапляючи на шкіру спричиняє хімічні опіки.
Хімічні властивості фенолу.
Фенол – хімічно активна сполука, причому підвищену реакційну здатність мають і гідроксильна група, і бензенове кільце.
1. Горіння фенолу: C6H5OH + 7О2 = 6СО2 + 3Н2О
2. Кислотні властивості. На відміну від спиртів, фенол виявляє кислотні властивості (раніше фенол називали карболовою кислотою). Однак сполука дисоціює у розчині дуже слабо:
C6H5OH ↔ H+ + C6H5O–
і не змінює забарвлення індикаторів. Кислотні властивості фенолу слабші, ніж у карбонатної кислоти.
3.Реакції з металами. Фенол, нагрітий до початку плавлення, взаємодіє з лужними металами з виділенням водню. Утворюються солі – феноляти.
2C6H5OH + 2Na → 2C6H5ONa + Н2↑
4. Реакції з лугами. Фенол, на відміну від спиртів, як слабка кислота взаємодіє з водними розчинами лугів з утворенням солей – фенолятів:
2C6H5OH + 2NaОН ↔ 2C6H5ONa + Н2О
5. Якісні реакції на фенол.
Гідроксильна група активує бензенове кільце молекули фенолу й сприяє заміщенню атомів гідрогену. Якщо до водного розчину фенолу долити бромну воду, то спостерігається знебарвлення реакційної суміші та поява білого осаду 2,4,6 – трибромофенолу:
C6H5OH + 3Вr2 → C6H2Вr3OН↓+3НВr
Іншою якісною реакцією є поява фіалкового забарвлення при взаємодії розчину фенолу з розчином ферум(III) хлориду. Спирти не взаємодіють із ферум(III) хлоридом.
Отже, взаємний вплив бензенового кільця і гідроксильної групи в молекулі фенолу зумовлює кислотні властивості сполуки та полегшує перебіг реакцій заміщення в бензеновому кільці (порівняно з бензеном).
Одержання фенолу.
1. З кам‘яновугільної смоли. Кам‘яновугільна смола, що утворюється при коксуванні вугілля – чорна в‘язка рідина з характерним фенольним запахом. Феноли виділяють з легкого масла – фракції одержаної при розгонці кам‘яновугільної смоли (to= 80 ‑ 170o С), в основному вона містить фенол і крезоли (метилфеноли). 2. Взаємодія галогенопохідних бензену з лугами. Заміщення галогену в бензеновому ядрі відбувається за жорстких умов: при температурі 200 – 300о С і підвищеному тиску із застосуванням каталізатора – міді і солей купруму (І): 3. Кумольним методом із кумолу (ізопропілбензену) добувають одразу дві цінні сполуки - фенол і ацетон:
3. Кумольним методом із кумолу (ізопропілбензену) добувають одразу дві цінні сполуки - фенол і ацетон: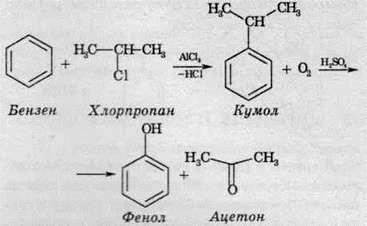
Застосування. Фенол є вихідною речовиною для виробництва барвників, лікувальних препаратів, пластичних мас, вибухових речовин. Фенол має антисептичні властивості, які були виявлені ще у другій половині XIX ст. Вони зумовлюють використання його розчину (5 %-го) для знезаражування приміщень, хірургічних інструментів, його добавляють до деяких сортів мила, ним протравлюють деревину, щоб запобігти її гниттю. Разом з тим, це токсична речовина. Він спричиняє порушення нервової системи, опіки шкіри, негативно впливає на шлунково-кишковий тракт, органи дихання. За постійної дії малих кількостей фенолу виникають головний біль і прискорене серцебиття, порушується сон, уражаються печінка і нирки. Існують жорсткі обмеження щодо вмісту фенолу у воді, яку використовують у побуті: в 1 л води не має бути більше 0,001 мг цієї сполуки.
Забруднення фенолом довкілля. Джерелами надходження фенолу в навколишнє середовище є коксохімічні заводи, підприємства з виробництва фенолоформальдегідних смол, сухої перегонки деревини. Потрапляючи разом із газовими викидами в атмосферу і зі стічними водами у водойми, фенол завдає серйозної шкоди рослинному і тваринному світу. Очищення промислових стоків від фенолу є одним із важливих технологічних завдань.
В Спирти — похідні вуглеводнів, молекули яких містять одну або кілька гідроксильних груп.
За кількістю гідроксильних груп у молекулі спирти поділяють на одно- і багатоатомні, а за особливостями хімічного зв’язку в карбоновому ланцюзі — на насичені, ненасичені, ароматичні.
Зважаючи на тип атома Карбону, з яким сполучена гідроксильна група, розрізняють первинні, вторинні й третинні одноатомні спирти. Загальна
формула одноатомних спиртів — R–ОН. Систематичні назви одноатомних спиртів складаються з назви алкану з таким самим карбоновим ланцюгом у молекулі і суфікса -ол.
Номер атома Карбону, з яким сполучена гідроксильна група, вказують перед суфіксом, а назви замісників — на початку назви спирту.
Структурна ізомерія спиртів зумовлена положенням гідроксильних груп у молекулах і будовою карбонового ланцюга.И
Насичені одноатомні спирти — похідні алканів, у молекулах яких міститься гідроксильна група. Загальна формула цих спиртів — СnH2n+1ОH.
Насичені одноатомні спирти — безбарвні рідини зі специфічним запахом або тверді речовини майже без запаху. Розчинність спиртів у воді зі збільшенням кількості атомів Карбону в молекулах зменшується.
Характерні реакції спиртів зумовлені наявністю в їхніх молекулах полярних зв’язків О–Н і С–О. Спирти взаємодіють із лужними металами, здатні до дегідратації й окиснення, є горючими речовинами.
У промисловості в найбільшій кількості добувають метиловий та етиловий спирти. Етанол використовують у медицині, фармакології, харчовій і хімічній промисловості, як компонент пального для автотранспорту, а метанол — у виробництві органічних сполук.
Етиловий спирт, потрапляючи в організм, завдає істотної шкоди, а метиловий спирт є сильною отрутою.СНОВКИ
Найпростішими двохатомним і трьохатомним спиртами є етиленгліколь і гліцерол.
Гліцерол — безбарвна в’язка рідина без запаху, солодка на смак, гігроскопічна, необмежено розчиняється у воді. Сполука взаємодіє з лужними металами, купрум(ІІ) гідроксидом.
Гліцерол використовують у виробництві вибухових речовин, косметичних засобів, а також у харчовій промисловості.









Комментарии
Отправить комментарий