ГМ-22 хімія 01.12.22
01.12.2022
Комбіноване заняття (2 год.)
Тема 3.3. Карбонові кислоти.
Опрацювати: Хімія 10 клас (за посиланням «Підручники»), §§18-19, с.109-120.
Виконати (письмово):
1. Завдання, що зустрічаються по ходу лекції і помічені "?"
2. Завдання 138, 140-146 на с.120:
138. Запишіть схему електролітичної дисоціації пропанової кислоти. Яких частинок більше в розчині сполуки — молекул кислоти чи йонів?
140. Напишіть рівняння реакцій і дайте назви їх продуктам:
НСООН + Mg →
СН3СООН + СuO →
СН3СООН + Mn(ОН)2→
HСООН + Na2SiO3→
С2Н5СООН + K2CO3→
С2Н5СООН + СН3OH →
141. Укажіть у йонно-молекулярних рівняннях замість крапок формули йонів, молекул:
а) Н+ + HСОО–→...;
б) ОН– + С2Н5СООН →... + ...;
в) SiO32– + 2СН3COOH →... + ... .
142. Запишіть у схемах перетворень замість крапок формули сполук і складіть рівняння відповідних реакцій:
а) C →CaC2→… →CH3CHO →… →CH3COONa;
б) C2Н4→C2H5ОН →CH3CНO →... →CH3COOС3Н7.
Укажіть умови, за яких відбуваються реакції.
143. Визначте масову частку оцтової кислоти в розчині, виготовленому додаванням до 100 г 80 %-го розчину кислоти:
а) 100 мл води;
б) 100 г 9 %-го розчину цієї кислоти;
в) 100 мл 20 %-го розчину цієї кислоти, густина якого 1,026 г/мл.
144. Яка маса розчину натрій гідроксиду з масовою часткою лугу 20% витрачається на нейтралізацію 50 г розчину пропанової кислоти з масовою часткою кислоти 7,4 %?
145. Яким об’ємом води потрібно розбавити 150 мл оцтової есенції (розчин оцтової кислоти з її масовою часткою 70 % і густиною 1,07 г/см3), щоб виготовити розчин із масовою часткою оцтової кислоти 5 %?
146. У суміш мурашиної та оцтової кислот масою 15,2 г добавили надлишок цинку. При цьому виділилося 3,36 л газу (н. у.). Визначте масові частки кислот у суміші.
Одним із важливих класів оксигеновмісних органічних сполук є клас карбонових кислот.
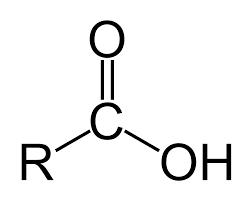
Молекули цих сполук містять характеристичну групу, до якої входять два атоми Оксигену: , або –СООН. Її назва — карбоксильна група.
Карбонові кислоти — похідні вуглеводнів, молекули яких містять одну або кілька карбоксильних груп.
Слово «карбоксильна» складається із частин назв груп атомів С=О (карбонільна) і О–Н (гідроксильна).
Загальна формула карбонових кислот з однією карбоксильною групою в молекулі R–COOH.
Поширеність у природі. Карбонові кислоти містяться в рослинах (наприклад, яблучна — у яблуках, винограді, лимонна — у цитрусових, щавлева — у щавлі, ревені), у тваринному світі (мурашина — у виділеннях мурашок, молочна — у молоці ссавців, м’язах після фізичного навантаження). Отже, тривіальні назви деяких кислот указують на їх природні джерела.
Класифікація. Карбонові кислоти класифікують за кількома ознаками.
Зважаючи на кількість карбоксильних груп у молекулі, розрізняють одноосновні карбонові кислоти (молекула містить одну групу –СООН, наприклад, оцтова кислота), двохосновні карбонові кислоти (молекула містить дві групи –СООН, наприклад, щавлева кислота) тощо.
За особливостями хімічних зв’язків у вуглеводневих залишках карбонові кислоти поділяють на насичені (масляна кислота С3Н7СООН, пальмітинова кислота С15Н31СООН, стеаринова кислота С17Н35СООН), ненасичені (акрилова кислота СН2=СН–СООН, олеїнова кислота CH3–(CH2)7–CH=CH–(CH2)7–COOH), ароматичні (бензойна кислота C6H5–COOH).
Карбонові кислоти, молекули яких містять 10 і більше атомів Карбону, називають вищими (пальмітинова, стеаринова, олеїнова кислоти).
Одноосновні карбонові кислоти.
Загальна формула насичених одноосновних карбонових кислот — СnH2n+1COOH, де n = 0, 1, … . Склавши всі атоми кожного елемента, отримаємо формулу Сn+1H2n+2O2, або СmH2mO2 (m = 1, 2, …).
У молекулах деяких органічних кислот, крім карбоксильних груп, містяться інші характеристичні групи. З огляду на це розрізняють амінокислоти, гідроксикислоти та ін.
У молекулах найпростіших за складом мурашиної НСООН та щавлевої НООС–СООН кислот немає вуглеводневих залишків.
Назви. Для карбонових кислот найбільш уживані тривіальні назви.
Систематична назва одноосновної карбонової кислоти складається із двох слів. Перше слово починається з назви вуглеводню з такою самою кількістю атомів Карбону, що й у головному карбоновому ланцюзі молекули кислоти (враховуючи атом Карбону карбоксильної групи), і закінчується на -ова.
Другим є слово кислота. Нумерацію в ланцюзі починають з атома Карбону карбоксильної групи, а в разі наявності замісників їх положення і назви (за алфавітом) указують на початку назви кислоти:
Формули і назви насичених одноосновних карбонових кислот.
Для найпростіших карбонових кислот іноді застосовують латинські назви: НСООН — форміатна кислота, СН3СООН — ацетатна кислота. Частіше використовують відповідні назви їх аніонів: форміат-іон (НСОО−), ацетат-іон (СН3СОО−). Від цих назв походять назви солей карбонових кислот.
? Напишіть формули калій форміату, кальцій ацетату.
Систематичні назви аніонів карбонових кислот складають, додаючи до назви відповідного вуглеводню суфікс -оат: НСОО– — метаноат-іон, СН3СОО– — етаноат-іон.
Ізомерія карбонових кислот (структурна) зумовлена різною будовою карбонового ланцюга молекул, а ненасичених кислот — ще й положенням кратного зв’язку. Для трьох найпростіших одноосновних карбонових кислот
насиченого ряду не існує ізомерів-кислот.ВИСНОВКИ
Будова молекул. У молекулі карбонової кислоти атом Карбону карбоксильної групи сполучений із двома атомами Оксигену й атомом Карбону вуглеводневого залишку. Кути між напрямами відповідних хімічних зв’язків наближаються до 120°. Це — результат перекривання змінених за формою орбіталей атома Карбону з орбіталями сусідніх атомів. В утворенні подвійного зв’язку С=О беруть участь також неспарені р-електрони атома Карбону й атома Оксигену. р-Орбіталь атома Карбону перекривається не лише з р-орбіталлю атома Оксигену карбонільної групи С=О, а й із р-орбіталлю атома Оксигену гідроксильної групи О–Н, у якій перебуває пара неподілених електронів. Утворюється спільна електронна система. Електронна густина в цій системі значною мірою зміщена до атома Оксигену карбонільної групи, що зумовлює більшу полярність зв’язку О–Н у молекулах карбонових кислот, ніж у молекулах спиртів. Зазначені особливості будови молекул карбонових кислот уможливлюють реакції за участю цих сполук із розривом полярних зв’язків О–Н, а також С–ОН.
Фізичні властивості. Мурашина, оцтова і пропіонова кислоти за звичайних умов є рідинами з різким запахом, які необмежено змішуються з водою з утворенням розчину. Розчиненню сприяє утворення водневих зв’язків між молекулами кислоти і води.
Масляна та інші кислоти з кількістю атомів Карбону в молекулах до дев’яти — оліїсті рідини, що мають неприємний запах і погано розчиняються у воді. Вищі насичені карбонові кислоти — тверді, нерозчинні у воді речовини без запаху.
Температури кипіння карбонових кислот вищі, ніж одноатомних спиртів із такою самою кількістю атомів Карбону в молекулах.
Це свідчить про сильнішу міжмолекулярну взаємодію в кислотах. Якщо між двома молекулами спирту виникає тільки один водневий зв’язок, то між молекулами кислоти їх може бути два.
Хімічні властивості. Карбонові кислоти, як і неорганічні кислоти, дисоціюють у водних розчинах з утворенням катіонів Гідрогену й аніонів кислотних залишків:
R–COOН ↔ Н+ + R–COO–.
Електролітична дисоціація цих сполук відбувається внаслідок розриву полярних зв’язків О–Н у молекулах.
? Складіть рівняння електролітичної дисоціації мурашиної та оцтової кислот.
Усі карбонові кислоти є слабкими. Зі зростанням карбонового ланцюга в молекулах сила насичених одноосновних карбонових кислот зменшується.
Реакції з металами, оксидами, гідроксидами, солями. Карбонові кислоти, як і більшість неорганічних кислот, взаємодіють з металами
Fe + 2CH3COOH →(CH3COO)2Fe + H2↑,
основними оксидами, основами, деякими амфотерними оксидами і гідроксидами, солями слабких кислот:
2HCOOH + Ва(ОН)2→(HCOO)2Ва + 2H2О;
2CH3COOH + Nа2СО3→2CH3COONа + СО2↑ + H2О.
? Складіть йонно-молекулярне рівняння реакції метанової кислоти з барій гідроксидом.
Реакції зі спиртами. Карбонові кислоти за наявності концентрованої сульфатної кислоти взаємодіють зі спиртами. Продуктами цих реакцій є естери. Звідси й назва — реакція естерифікації:
Установлено, що кожна молекула води утворюється за рахунок ОН-групи молекули кислоти й атома Гідрогену гідроксильної групи молекули спирту.
Оцтова кислота є стійкою щодо дії окисників. Вона не взаємодіє, наприклад, із калій перманганатом. Однак пару цієї кислоти можна підпалити на повітрі.
Мурашина кислота — єдина з карбонових кислот, у молекулі якої міститься альдегідна група . Тому ця сполука, як і альдегіди, окиснюється калій перманганатом, аргентум(І) оксидом в амоніачному розчині (дає реакцію «срібного дзеркала».
При нагріванні з концентрованою сульфатною кислотою мурашина кислота розкладається на карбон(II) оксид і воду:
t, H2SO4(конц.)
НСООН → СО + Н2О.
Добування. Карбонові кислоти добувають у промисловості переважно за реакціями окиснення.
Основний і перспективний метод добування оцтової та мурашиної кислот ґрунтується на окисненні насичених вуглеводнів — н-бутану, метану:
2CH3–CH2–CH2–CH3 + 5О2 → 4СН3СООН + 2Н2О;
2СН4 + 3О2 → 2HCOOH + 2H2O.
Карбонові кислоти утворюються при окисненні альдегідів і спиртів.
У лабораторії карбонові кислоти найчастіше добувають за реакціями їхніх солей із сильними неорганічними кислотами (зазвичай сульфатною):
2RCOONa + H2SO4→2RCOOH + Na2SO4.
Добувати оцтову кислоту в лабораторії недоцільно, оскільки її у великій кількості випускає промисловість.
Застосування. Найбільшого використання серед карбонових кислот набули етанова (оцтова) й метанова (мурашина) кислоти. Оцтову кислоту широко застосовують у харчовій, шкіряній, хімічній промисловості, при фарбуванні
тканин, у виробництві штучних волокон, домашньому господарстві (для консервування, як приправу до їжі тощо). Промисловість випускає столовий оцет (водний розчин оцтової кислоти з її масовою часткою 5—10 %), оцтову
есенцію (70—80 %), яблучний оцет. Мурашину кислоту застосовують в органічному синтезі, текстильній промисловості, медицині, виробництві фарб, гуми.
В Карбонові кислоти — похідні вуглеводнів, молекули яких містять одну або кілька карбоксильних груп. Загальна формула одноосновних карбонових кислот — R–COOH.
Карбонові кислоти поширені в природі.
Карбонові кислоти класифікують за кількістю карбоксильних груп у молекулі, особливостями ковалентного зв’язку в карбоновому ланцюзі. Для цих сполук використовують переважно тривіальні назви.
Ізомерія карбонових кислот зумовлена різною будовою карбонового ланцюга в молекулах, а ненасичених кислот — ще й положенням кратних зв’язків.ИСНОВКИ
Карбонові кислоти за звичайних умов є рідинами або твердими речовинами. Розчинність їх у воді зменшується зі зростанням кількості
атомів Карбону в молекулах. Ці сполуки мають вищі температури кипіння, ніж відповідні спирти.
Карбонові кислоти дисоціюють у водних розчинах, реагують із металами, деякими оксидами, гідроксидами, солями, а також зі спиртами.
У промисловості карбонові кислоти добувають окисненням органічних сполук.
Карбонові кислоти використовують у багатьох сферах.



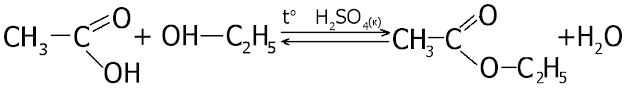
Комментарии
Отправить комментарий