Виконати (письмово) завдання:
1. Як
розрізнити водні розчини етанолу і гліцеролу за допомогою хімічної реакції?
2. Напишіть рівняння реакції горіння гліцеролу.
3. За матеріалами з інтернету
або інших джерел інформації підготуйте коротке повідомлення про те, які виробництва можуть
забруднювати довкілля фенолом. Чи входить до їх складу металургійне виробництво?
4. Складіть рівняння реакцій фенолу з літієм, калій
гідроксидом і назвіть сполуки, які утворюються.
5. Наведіть приклади якісних реакцій на фенол.
6. Який об’єм водню (н. у.)
виділиться в результаті взаємодії 2,3 г натрію з надлишком фенолу?
7. Масові частки Карбону й
Оксигену в органічній сполуці становлять відповідно 76,6 і 17,0 %, а відносна
молекулярна маса — 94.
Визначте формулу сполуки.
Багатоатомні спирти.
Найпростішим двохатомним спиртом є етиленгліколь НО–СН2–СН2–ОН, а трьохатомним спиртом — гліцерол, або гліцерин НОСН2–СНОН–СН2ОН. У природі цих спиртів немає, але похідні гліцеролу — жири — дуже поширені.
Фізичні властивості гліцеролу. Трьохатомний спирт гліцерол — безбарвна в’язка рідина, солодка на смак. Ця сполука не має запаху, гігроскопічна, трохи важча за воду, змішується з нею в будь-яких співвідношеннях з утворенням розчину.
Цікаво знати: в’язкість гліцеролу за звичайних умов у тисячу разів більша, ніж води.
Гліцерол кипить, розкладаючись, за температури +290°С, тоді як температури кипіння одноатомних спиртів (пропанолів) із такою самою кількістю атомів Карбону в молекулах значно нижчі. Відмінності зумовлені тим, що в багатоатомному спирті утворюється більше водневих зв’язків (кожна молекула гліцеролу містить три ОН-групи).
Хімічні властивості. Гліцерол взаємодіє не лише з активними металами, а й із деякими гідроксидами металічних елементів, зокрема з купрум(ІІ) гідроксидом. Цим він більше, ніж одноатомні спирти, нагадує кислоту. Однак гліцерол і його розчин не змінюють забарвлення індикаторів.
Реакції з металами. Під час взаємодії гліцеролу з лужними металами відбувається послідовне заміщення атомів Гідрогену в гідроксильних групах на атоми металічного елемента. Запис рівняння реакції цього спирту з надлишком натрію:
2С3Н5(ОН)3 + 6Na → 2С3Н5(ОNa)3 + 3Н2↑.
Щоб така реакція відбувалася з достатньою швидкістю, гліцерол нагрівають.
Сполуки металічних елементів, що є похідними гліцеролу, називають гліцератами.
Реакція з купрум(ІІ) гідроксидом. Якщо до щойно добутого за реакцією обміну осаду купрум(II) гідроксиду додати водний розчин гліцеролу, то осад розчиняється, а рідина набуває яскраво-синього кольору. Назва продукту взаємодії — купрум(ІІ) гліцерат. Ця реакція є якісною на багатоатомні спирти (на фрагмент молекули –СНОН–СНОН–).
Окиснення. Гліцерол горить на повітрі з утворенням вуглекислого газу і води. Щоб провести такий дослід, невелику кількість спирту нагрівають у порцеляновій чашці й підпалюють за допомогою скіпки. Сполука горить майже безбарвним полум’ям.
Добування і застосування. Гліцерол добувають у промисловості різними методами. Традиційний метод ґрунтується на гідролізі жирів.
Гліцерол для технічних потреб синтезують із пропену.
Значні кількості гліцеролу використовують у виробництві вибухових речовин. Цю сполуку також застосовують для пом’якшення шкіри при виготовленні взуття та одягу.
Гліцерол є компонентом зубних паст, мила, косметичних кремів. Іноді його добавляють у лікери для надання їм в’язкості.
Водні розчини двохатомного спирту етиленгліколю застосовують узимку для охолодження двигунів в автомобілях. Назва цих рідин — антифризи. Термін походить від англійського слова freeze — замерзати. Антифризи не замерзають за низьких температур. Водіям слід пам’ятати, що етиленгліколь дуже токсичний.
Феноли – органічні сполуки, у яких гідроксильна група безпосередньо зв’язана з бензеновим ядром.
Найпростішою сполукою цього класу речовин є фенол С6Н5ОН. Його можна розглядати як похідну бензену, в молекулі якого один з атомів Гідрогену заміщений на гідроксильну групу:
Зверніть увагу! Фенол не зараховують до класу спиртів, оскільки гідроксильна група в його молекулі безпосередньо сполучена з бензеновим кільцем.
Будова молекули. Наявність бензенового кільця в молекулі фенолу С6Н5ОН зумовлює більшу рухливість атома Гідрогену в ОН-групі, ніж у молекулах одноатомних спиртів ROH. Якщо в молекулі спирту вуглеводневий замісник віддає частину своєї електронної густини атому Оксигену (СН3→ОН), що призводить до зменшення полярності зв’язку О–Н, то в молекулі фенолу навпаки — атом Оксигену «збагачує» електронною густиною бензенове кільце. Неподілена пара р-електронів атома Оксигену, «втягуючись» у кільце, утворює з р-електронами атомів Карбону спільну електронну систему. Довжина зв’язку С–О зменшується, і він стає міцнішим.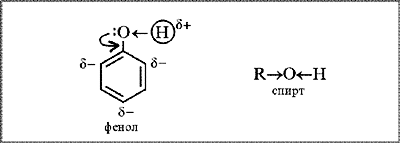
Атом Оксигену, компенсуючи втрату електронної густини, сильніше зміщує у свій бік спільну з атомом Гідрогену електронну пару (С6Н5–О←Н). Полярність зв’язку О–Н зростає; атом Гідрогену в молекулі фенолу набуває більшого позитивного заряду, ніж у молекулі спирту, стає рухливішим, а тому легше заміщується на інші атоми під час хімічних реакцій.
Гідроксильна група також впливає і на бензенове кільце. Вона спричиняє підвищену рухливість атомів Гідрогену бензенового кільця біля двох найближчих і найвіддаленішого атомів Карбону, де зосереджується найбільша електронна густина. Відповідні позиції в молекулі фенолу називають орто- і пара-положеннями.
Фізичні властивості фенолу. Фенол — безбарвна кристалічна речовина з різьким характерним запахом. 
У разі зберігання в нещільно закритому посуді поступово окиснюється і набуває рожевого кольору (t°пл=43°С, t°кип=182°С).
У холодній воді фенол розчиняється погано. Але якщо додати у пробірку з фенолом гарячої води, спостерігатиметься його швидке розчинення. Фенол має виражені антисептичні властивості, його водний розчин використовують для знезараження приміщень, хірургічного інструменту. Фенол токсичний. Потрапляючи на шкіру спричиняє хімічні опіки.
Хімічні властивості фенолу.
Фенол – хімічно активна сполука, причому підвищену реакційну здатність мають і гідроксильна група, і бензенове кільце.
1. Горіння фенолу: C6H5OH + 7О2 = 6СО2 + 3Н2О
2. Кислотні властивості. На відміну від спиртів, фенол виявляє кислотні властивості (раніше фенол називали карболовою кислотою). Однак сполука дисоціює у розчині дуже слабо:
C6H5OH ↔ H+ + C6H5O–
і не змінює забарвлення індикаторів. Кислотні властивості фенолу слабші, ніж у карбонатної кислоти.
3.Реакції з металами. Фенол, нагрітий до початку плавлення, взаємодіє з лужними металами з виділенням водню. Утворюються солі – феноляти.
2C6H5OH + 2Na → 2C6H5ONa + Н2↑
4. Реакції з лугами. Фенол, на відміну від спиртів, як слабка кислота взаємодіє з водними розчинами лугів з утворенням солей – фенолятів:
2C6H5OH + 2NaОН ↔ 2C6H5ONa + Н2О
5. Якісні реакції на фенол.
Гідроксильна група активує бензенове кільце молекули фенолу й сприяє заміщенню атомів гідрогену. Якщо до водного розчину фенолу долити бромну воду, то спостерігається знебарвлення реакційної суміші та поява білого осаду 2,4,6 – трибромофенолу:
C6H5OH + 3Вr2 → C6H2Вr3OН↓+3НВr
Іншою якісною реакцією є поява фіалкового забарвлення при взаємодії розчину фенолу з розчином ферум(III) хлориду. Спирти не взаємодіють із ферум(III) хлоридом.
Отже, взаємний вплив бензенового кільця і гідроксильної групи в молекулі фенолу зумовлює кислотні властивості сполуки та полегшує перебіг реакцій заміщення в бензеновому кільці (порівняно з бензеном).
Одержання фенолу.
1. З кам‘яновугільної смоли. Кам‘яновугільна смола, що утворюється при коксуванні вугілля – чорна в‘язка рідина з характерним фенольним запахом. Феноли виділяють з легкого масла – фракції одержаної при розгонці кам‘яновугільної смоли (to= 80 ‑ 170o С), в основному вона містить фенол і крезоли (метилфеноли). 2. Взаємодія галогенопохідних бензену з лугами. Заміщення галогену в бензеновому ядрі відбувається за жорстких умов: при температурі 200 – 300о С і підвищеному тиску із застосуванням каталізатора – міді і солей купруму (І): 3. Кумольним методом із кумолу (ізопропілбензену) добувають одразу дві цінні сполуки - фенол і ацетон:
3. Кумольним методом із кумолу (ізопропілбензену) добувають одразу дві цінні сполуки - фенол і ацетон: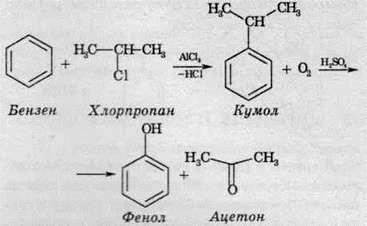
Застосування. Фенол є вихідною речовиною для виробництва барвників, лікувальних препаратів, пластичних мас, вибухових речовин. Фенол має антисептичні властивості, які були виявлені ще у другій половині XIX ст. Вони зумовлюють використання його розчину (5 %-го) для знезаражування приміщень, хірургічних інструментів, його добавляють до деяких сортів мила, ним протравлюють деревину, щоб запобігти її гниттю. Разом з тим, це токсична речовина. Він спричиняє порушення нервової системи, опіки шкіри, негативно впливає на шлунково-кишковий тракт, органи дихання. За постійної дії малих кількостей фенолу виникають головний біль і прискорене серцебиття, порушується сон, уражаються печінка і нирки. Існують жорсткі обмеження щодо вмісту фенолу у воді, яку використовують у побуті: в 1 л води не має бути більше 0,001 мг цієї сполуки.
Забруднення фенолом довкілля. Джерелами надходження фенолу в навколишнє середовище є коксохімічні заводи, підприємства з виробництва фенолоформальдегідних смол, сухої перегонки деревини. Потрапляючи разом із газовими викидами в атмосферу і зі стічними водами у водойми, фенол завдає серйозної шкоди рослинному і тваринному світу. Очищення промислових стоків від фенолу є одним із важливих технологічних завдань.
Найпростішими двохатомним і трьохатомним спиртами є етиленгліколь і гліцерол.
Гліцерол — безбарвна в’язка рідина без запаху, солодка на смак, гігроскопічна, необмежено розчиняється у воді. Сполука взаємодіє з лужними металами, купрум(ІІ) гідроксидом.
Гліцерол використовують у виробництві вибухових речовин, косметичних засобів, а також у харчовій промисловості.
Фенол С6Н5ОН — сполука, похідна бензену, в молекулі якої замість атома Гідрогену міститься гідроксильна група. Вона не належить до класу спиртів. Фенол — тверда безбарвна речовина з характерним запахом, необмежено розчинна в гарячій воді. Ця сполука взаємодіє з лужними металами, лугами, бромною водою. Фенол добувають із вуглеводневої сировини. Його використовують у виробництві органічних речовин, пластмас. Фенол дуже токсичний.




Комментарии
Отправить комментарий