ПМ-19 Хімія
Виконані завдання надіслати на електронну пошту nataliasuhina15@gmail.com до 30.05.2020
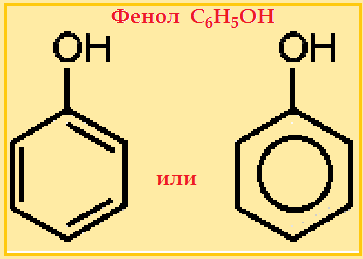
Феноли – органічні сполуки, у яких
гідроксильна група безпосередньо зв’язана з бензеновим ядром.
Найпростішою сполукою цього класу речовин є фенол С6Н5ОН. Його можна розглядати як похідну бензену, в молекулі якого один з атомів
Гідрогену заміщений на гідроксильну групу:
Фенол – хімічно активна сполука, причому підвищену реакційну здатність
мають і гідроксильна група, і бензенове кільце.
1. Горіння фенолу: C6H5OH
+ 7О2 = 6СО2 + 3Н2О
2. Кислотні властивості. На відміну від спиртів, фенол
виявляє кислотні властивості (раніше фенол називали карболовою кислотою). Однак
сполука дисоціює у розчині дуже слабо:
C6H5OH ↔ H+ + C6H5O–
і не змінює забарвлення індикаторів. Кислотні властивості фенолу слабші,
ніж у карбонатної кислоти.
3.Реакції з металами. Фенол, нагрітий до початку плавлення, взаємодіє з лужними металами з
виділенням водню. Утворюються солі – феноляти.
2C6H5OH +
2Na → 2C6H5ONa + Н2↑
4. Реакції з лугами. Фенол, на відміну від спиртів, як слабка кислота взаємодіє з водними
розчинами лугів з утворенням солей – фенолятів:
2C6H5OH + 2NaОН ↔ 2C6H5ONa +
Н2О
5. Якісні реакції на фенол.
Гідроксильна група активує бензенове кільце молекули фенолу й сприяє
заміщенню атомів гідрогену. Якщо до водного розчину фенолу долити бромну воду,
то спостерігається знебарвлення реакційної суміші та поява білого осаду 2,4,6 –
трибромофенолу:
C6H5OH + 3Вr2 → C6H2Вr3OН↓+3НВr

Отже, взаємний вплив бензенового кільця і гідроксильної групи в молекулі
фенолу зумовлює кислотні властивості сполуки та полегшує перебіг реакцій
заміщення в бензеновому кільці (порівняно з бензеном).
28.05.2020
Лекція (2 год.)
Тема 3.2. Фенол.
Опрацювати: Хімія 10 клас (за посиланням «Підручники»), с.95-101, §16,
лекційний матеріал
Виконати
(письмово):
1. Чому фенол, на відміну від етанолу, виявляє кислотні
властивості?
2. Як
впливає бензенове кільце на полярність зв’язку О–Н у молекулі фенолу?
3. За
матеріалами з інтернету або інших джерел інформації підготуйте коротке повідомлення про те, які виробництва можуть забруднювати довкілля фенолом. Чи входить до їх складу
металургійне виробництво?
4. Складіть рівняння реакцій
фенолу з літієм, калій гідроксидом і назвіть сполуки, які утворюються.
5. Наведіть приклади якісних
реакцій на фенол.
6. Який
об’єм водню (н. у.) виділиться в результаті взаємодії 2,3 г натрію з надлишком фенолу?
7. Масові
частки Карбону й Оксигену в органічній сполуці становлять відповідно 76,6 і
17,0 %, а відносна молекулярна маса — 94. Визначте формулу сполуки.
Феноли – органічні сполуки, у яких
гідроксильна група безпосередньо зв’язана з бензеновим ядром.
Найпростішою сполукою цього класу речовин є фенол С6Н5ОН. Його можна розглядати як похідну бензену, в молекулі якого один з атомів
Гідрогену заміщений на гідроксильну групу:

Зверніть увагу! Фенол не зараховують до класу спиртів, оскільки гідроксильна група в його молекулі
безпосередньо сполучена з бензеновим кільцем.
Будова молекули. Наявність бензенового кільця в молекулі фенолу С6Н5ОН
зумовлює більшу
рухливість атома Гідрогену в ОН-групі, ніж у молекулах одноатомних спиртів ROH. Якщо в молекулі спирту вуглеводневий замісник віддає частину своєї електронної густини атому Оксигену (СН3→ОН), що
призводить до зменшення полярності зв’язку О–Н, то в молекулі фенолу навпаки — атом Оксигену «збагачує»
електронною густиною бензенове
кільце. Неподілена пара р-електронів
атома Оксигену, «втягуючись» у кільце, утворює з р-електронами атомів Карбону спільну електронну систему. Довжина зв’язку С–О
зменшується, і він стає міцнішим.
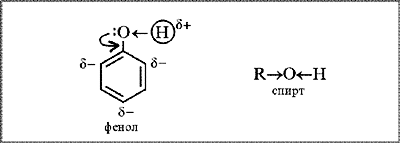

Атом Оксигену, компенсуючи втрату електронної густини, сильніше зміщує у
свій бік спільну з
атомом Гідрогену електронну пару (С6Н5–О←Н). Полярність
зв’язку О–Н зростає; атом
Гідрогену в молекулі фенолу набуває більшого позитивного заряду, ніж у молекулі
спирту, стає рухливішим, а тому легше заміщується на інші атоми під час
хімічних реакцій.
Гідроксильна група також впливає і на бензенове кільце. Вона спричиняє підвищену рухливість атомів Гідрогену бензенового
кільця біля двох найближчих і найвіддаленішого атомів Карбону, де зосереджується найбільша електронна
густина:


Відповідні позиції в молекулі фенолу називають орто- і пара-положеннями.
Фізичні властивості фенолу. Фенол —
безбарвна кристалічна речовина з різьким характерним запахом.


У разі
зберігання в нещільно закритому посуді поступово окиснюється і набуває рожевого
кольору (t°пл=43°С, t°кип=182°С).


Хімічні властивості фенолу.
Фенол – хімічно активна сполука, причому підвищену реакційну здатність
мають і гідроксильна група, і бензенове кільце.
1. Горіння фенолу: C6H5OH
+ 7О2 = 6СО2 + 3Н2О
2. Кислотні властивості. На відміну від спиртів, фенол
виявляє кислотні властивості (раніше фенол називали карболовою кислотою). Однак
сполука дисоціює у розчині дуже слабо:
C6H5OH ↔ H+ + C6H5O–
і не змінює забарвлення індикаторів. Кислотні властивості фенолу слабші,
ніж у карбонатної кислоти.
3.Реакції з металами. Фенол, нагрітий до початку плавлення, взаємодіє з лужними металами з
виділенням водню. Утворюються солі – феноляти.
2C6H5OH +
2Na → 2C6H5ONa + Н2↑
4. Реакції з лугами. Фенол, на відміну від спиртів, як слабка кислота взаємодіє з водними
розчинами лугів з утворенням солей – фенолятів:
2C6H5OH + 2NaОН ↔ 2C6H5ONa +
Н2О
5. Якісні реакції на фенол.
Гідроксильна група активує бензенове кільце молекули фенолу й сприяє
заміщенню атомів гідрогену. Якщо до водного розчину фенолу долити бромну воду,
то спостерігається знебарвлення реакційної суміші та поява білого осаду 2,4,6 –
трибромофенолу:
C6H5OH + 3Вr2 → C6H2Вr3OН↓+3НВr

Іншою якісною реакцією є поява фіалкового забарвлення
при взаємодії розчину фенолу з розчином
ферум(III) хлориду. Спирти не
взаємодіють із ферум(III) хлоридом.
Отже, взаємний вплив бензенового кільця і гідроксильної групи в молекулі
фенолу зумовлює кислотні властивості сполуки та полегшує перебіг реакцій
заміщення в бензеновому кільці (порівняно з бензеном).
Одержання фенолу.
1. З кам‘яновугільної смоли. Кам‘яновугільна смола, що утворюється при коксуванні вугілля – чорна
в‘язка рідина з характерним фенольним запахом. Феноли виділяють з легкого масла
– фракції одержаної при розгонці кам‘яновугільної смоли (to= 80 ‑
170o С), в основному вона містить фенол і крезоли
(метилфеноли).
2. Взаємодія
галогенопохідних бензену з лугами. Заміщення
галогену в бензеновому ядрі відбувається за жорстких умов: при температурі 200 –
300о С і підвищеному тиску із застосуванням каталізатора – міді
і солей купруму (І):

3. Кумольним методом із кумолу (ізопропілбензену) добувають одразу дві цінні сполуки - фенол і ацетон:
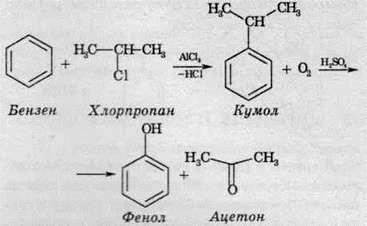
3. Кумольним методом із кумолу (ізопропілбензену) добувають одразу дві цінні сполуки - фенол і ацетон:

Застосування. Фенол є вихідною речовиною для
виробництва барвників, лікувальних препаратів, пластичних мас, вибухових
речовин. Фенол має антисептичні властивості, які були виявлені ще у другій
половині XIX ст. Вони зумовлюють використання його розчину (5 %-го) для
знезаражування приміщень, хірургічних інструментів, його добавляють до деяких
сортів мила, ним протравлюють деревину, щоб запобігти її гниттю. Разом з тим, це токсична
речовина. Він спричиняє порушення нервової системи, опіки шкіри, негативно впливає на шлунково-кишковий
тракт, органи дихання. За постійної дії малих кількостей фенолу виникають головний біль і
прискорене серцебиття, порушується сон, уражаються печінка і нирки. Існують жорсткі
обмеження щодо вмісту фенолу у воді, яку використовують у побуті: в 1 л води не має бути більше 0,001 мг цієї
сполуки.
Забруднення фенолом довкілля. Джерелами
надходження фенолу в навколишнє середовище є коксохімічні заводи, підприємства
з виробництва
фенолоформальдегідних смол, сухої перегонки деревини. Потрапляючи разом із газовими викидами в атмосферу і зі стічними водами у водойми,
фенол завдає серйозної шкоди рослинному і тваринному світу. Очищення промислових стоків
від фенолу є одним із
важливих технологічних завдань.
Фенол С6Н5ОН — сполука, похідна бензену, в молекулі якої
замість атома Гідрогену міститься гідроксильна група. Вона не належить до класу спиртів. Фенол — тверда безбарвна речовина з характерним запахом, необмежено
розчинна в гарячій воді. Ця сполука взаємодіє з лужними металами, лугами,
бромною водою. Фенол добувають із вуглеводневої сировини. Його використовують у виробництві органічних речовин,
пластмас. Фенол дуже токсичний.

Комментарии
Отправить комментарий