ПМ-19 Хімія
Виконані завдання надіслати на електронну пошту nataliasuhina15@gmail.com до 20.04.2020
17.04.2020
Лекція (2 год.)
Тема 2.3. Арени.
Опрацювати: Хімія 10 клас (за посиланням «Підручники»), с.45-60, §§ 8-10, лекційний матеріал
Виконати (письмово):
1. У чому полягає
особливість будови молекули бензену? Запишіть молекулярну і
структурну формули бензену.
2. Як впливають
умови на взаємодію бензену з хлором? Напишіть рівняння відповідних
хімічних реакцій.
3. Напишіть рівняння хімічних реакцій, які відбуваються при взаємодії
бензену з:
а) воднем;
б) бромом за наявності
каталізатора FeBr3;
в) киснем.
4. Яка відносна
густина за воднем пари бензену?
5. Визначте
масову частку Карбону в бензені й зіставте її з масовою часткою цього елемента в
етині.
6. Обчисліть
масу продукту реакції гідрування бензену, взятого об’ємом 17,7мл. Густину
ароматичного вуглеводню наведено в тексті лекції.
7. Суміш ацетилену і парів
бензену має відносну густину за воднем 23,4. Обчисліть об’ємні частки
сполук у газовій суміші.
Існує велика група сполук Карбону з Гідрогеном, назва
якої доволі незвичайна — ароматичні вуглеводні. Вона пов’язана з тим, що раніше ці сполуки добували з природних духмяних смол. Проте спільна ознака
таких сполук — не запах, а особлива будова молекул.
Бензен. Найпростішим
ароматичним вуглеводнем є бензен С6Н6 (тривіальна
назва — бензол). Цю cполуку відкрив у 1825 р. англійський
учений М. Фарадей; вона у вигляді рідини
накопичувалася в ємностях зі світильним газом, який використовували у вуличних ліхтарях.
Будова молекули. Властивості бензену, виявлені хіміками, не давали
змоги однозначно описати будову його молекули. Атомів Гідрогену в
молекулі бензену С6Н6 значно менше, ніж у молекулі насиченого вуглеводню гексану С6Н14.
Це вказувало на наявність у молекулі бензену
подвійних або навіть потрійних зв’язків (тобто бензен мав бути ненасиченим
вуглеводнем). Однак сполука виявилася хімічно пасивною (як і
насичені вуглеводні), на відміну від алкенів і
алкінів не знебарвлювала бромної води, розчину
калій перманганату. Щоправда, за особливих умов молекула С6Н6
усе ж приєднувала три молекули водню або хлору.
Також було з’ясовано, що похідні бензену з одним атомом галогену в молекулах не мали ізомерів (у разі
відкритого карбонового ланцюга існування ізомерів є очевидним). Це свідчило про рівноцінність розміщення атомів Карбону в молекулі С6Н6,
що можливо лише при їх сполученні в замкнений ланцюг.
Ураховуючи сукупність виявлених фактів, учені запропонували кілька структурних формул молекули бензену. Із
більшістю фактів найкраще узгоджувалася формула німецького хіміка Ф.-А. Кекуле.
Фрідріх-Август Кекуле (1829—1896) запропонував циклічну
формулу молекули бензену:
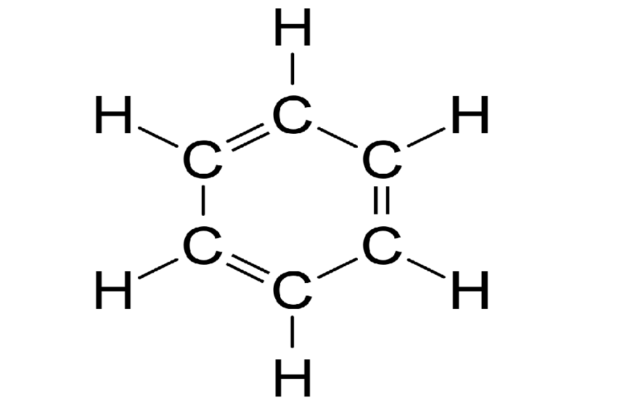
Однак і вона не пояснювала,
чому бензен, маючи кратні
зв’язки, за звичайних умов не вступав у реакції приєднання.
Результати подальших
досліджень показали рівноцінність атомів Карбону в молекулі бензену, а також
їх розміщення в одній площині, в кутах правильного
шестикутника.
Згідно із сучасними
уявленнями, між атомами Карбону в молекулі бензену немає звичайних простих і
подвійних зв’язків. Орбіталі одного 2s-електрона і двох 2p-електронів кожного
атома Карбону при утворенні хімічних зв’язків змінюють форму на
однакову й розміщуються під кутами 120°. Вони перекриваються з
відповідними орбіталями сусідніх атомів Карбону й атома
Гідрогену. Орбіталь
третього р-електрона
зберігає свою форму й
орієнтується перпендикулярно до площини молекули. Унаслідок перекривання шістьох
таких орбіталей електронна
густина рівномірно розподіляється по карбоновому циклу, зосереджуючись над і під його площиною. Отже, в молекулі бензену
існує замкнена електронна
система, утворена p-електронами:
Тому структурну формулу
молекули С6Н6 часто зображують так:
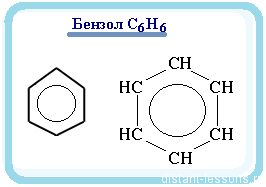
Молекула бензену завдяки
своїй симетричності неполярна.
Фізичні властивості. Бензен — безбарвна летка рідина зі своєрідним
запахом, легша за воду (густина
0,88 г/см3). Температура плавлення бензену +5,5 °С, кипіння +80,1 °С. Сполука погано
розчиняється у воді, але добре —
в органічних розчинниках.
Цей вуглеводень розчиняє йод,
сірку, білий фосфор, жири, інші органічні
речовини.
Бензен — одна з
найстійкіших органічних сполук; його
пара не розкладається до 600 °С.
Хімічні властивості. Бензен хоч і є подібним до
ненасичених вуглеводнів, проте виявляє достатню хімічну
пасивність. Характерними для сполуки є
реакції заміщення, під час яких зберігається електронна система бензенового
кільця. Реакції приєднання
й окиснення за участю бензену
призводять до руйнування цієї системи;
вони відбуваються за високої температури, дії ультрафіолетового випромінювання,
наявності каталізаторів.
Реакції заміщення. Атоми Гідрогену в молекулі бензену можуть заміщуватись на атоми галогенів. Із хлором і
бромом сполука взаємодіє за наявності каталізаторів. Найлегше відбувається
перша стадія — заміщення одного атома Гідрогену в молекулі бензену:

Реакції приєднання. Бензен, як і ненасичені вуглеводні, може вступати в реакції приєднання. Вони відбуваються за
жорстких умов:
С6Н6+3Н2→С6Н12
циклогексан

С6Н6+3Сl2→С6Н6Сl6
1,2,3,4,5,6-гексахлороциклогексан

Реакція окиснення. Бензен, як і інші вуглеводні, є горючою речовиною. Під час горіння сполуки на повітрі, крім
вуглекислого газу і води,
утворюється невелика кількість вуглецю. Його часточки розжарюються в полум’ї (воно стає яскравим), а
потім згоряють. Горіння бензену супроводжується появою кіптяви:
2С6Н6+15О2→12СО2+6Н2О
Через особливу стійкість
молекули бензен інертний щодо
речовин-окисників.
Зокрема, він не
взаємодіє з калій перманганатом. Цим бензен відрізняється від
алкенів і алкінів.
Арени. Крім бензену, відомо багато
вуглеводнів із подібною замкненою електронною системою в молекулах, утвореною р-електронами.
Вуглеводні, у молекулах
яких є одне чи кілька бензенових кілець, називають аренами, або ароматичними вуглеводнями.
Бензен С6Н6
є першою сполукою в гомологічному ряду аренів з одним бензеновим кільцем у
молекулі.
ВИСНОВКИ
Бензен С6Н6
— найпростіший ароматичний вуглеводень.
У молекулі бензену всі
атоми Карбону розміщені в одній площині у вершинах правильного шестикутника. Замкнена
електронна система в молекулі бензену, утворена р-електронами, зумовлює хімічну стійкість
сполуки.
Бензен — безбарвна летка
рідина зі своєрідним запахом, легша за воду, добре розчиняється в органічних розчинниках.
Сполука вступає в реакції
заміщення, приєднання й окиснення.
Вуглеводні з одним або
кількома бензеновими кільцями в молекулах називають аренами, або ароматичними
вуглеводнями.



Комментарии
Отправить комментарий