ПМ-19 Хімія
Виконані завдання за цією темою і практичну роботу№1 надіслати на електронну пошту nataliasuhina15@gmail.com до 12.04.2020
09.04.2020
Лекція (2 год.)
Тема 2.1. Алкани.
Опрацювати: Хімія 10 клас (за посиланням «Підручники»), с.27-40, §§ 5,6
Виконати (письмово):
1. Замалюйте в зошит схему «Класифікація вуглеводнів за особливостями зв’язку між атомами Карбону»
2. Замалюйте в зошит таблицю «Алкани»
3. Випишіть в зошит правила складання назв
алканів розгалуженої будови
4. Виконайте завдання 27-30, 33-35,
36-42
5. Складіть структурну формулу алкану, назва
якого — 4-етил-2,2-диметилгептан.
Вуглеводні — сполуки Карбону
з Гідрогеном. Такі сполуки містяться в природному газі, нафті. Вони слугують паливом, пальним,
сировиною в різних виробництвах.
Вуглеводні становлять основу органічної хімії. Одне з означень цієї галузі хімічної науки таке: органічна хімія —
хімія вуглеводнів та їх похідних. Похідними називають продукти заміщення атомів Гідрогену в
молекулах вуглеводнів на атоми інших елементів або групи сполучених атомів
(–ОН,
–СООН, –NH2 та ін.).
Загальна формула вуглеводнів — СnHm.
Ці сполуки
поділяють на дві групи — з відкритим і замкненим карбоновим ланцюгом у молекулах. Існує
також їх поділ за особливостями зв’язку між атомами Карбону (схема).
Схема
Класифікація вуглеводнів за особливостями
зв’язку
між атомами Карбону

Склад молекул. Найпростішим насиченим вуглеводнем є метан СН4. Він започатковує
гомологічний ряд, до
якого зараховують сполуки з формулами С2Н6, С3Н8
та багато інших. Гомологічний
ряд — це ряд органічних сполук (гомологів), молекули яких подібні за будовою й
різняться на одну або кілька груп атомів СН2 (так звана гомологічна різниця).
Насичені вуглеводні, молекули яких мають відкритий карбоновий
ланцюг, називають алканами.
Загальна формула алканів — СnH2n+2 (n
= 1,2, ...). У молекулах цих вуглеводнів усі атоми сполучені простим
ковалентним зв’язком, а кути між
лініями, що з’єднують центри сусідніх атомів, становлять 109,5°. Вуглеводні СН4, С2Н6,
С3Н8 та інші аналогічні сполуки є гомологами й утворюють гомологічний
ряд алканів.
Ізомерія. Для алканів, крім метану СН4, етану С2Н6
і пропану С3Н8, існують ізомери.
Пригадайте: Сполуки, які мають однаковий склад, але різну будову молекул,
називають ізомерами, а явище існування таких сполук — ізомерією.
Формулу С4Н10 мають два алкани. Молекула одного з них
містить нерозгалужений карбоновий ланцюг, а іншого — розгалужений:
Відомо три алкани з формулою С5Н12, п’ять — із формулою С6Н14,
дев’ять — із формулою С7Н16, а кількість ізомерів, які
мають формулу С10Н22,
сягає 75. Отже, зі збільшенням числа атомів Карбону в молекулах алканів
кількість ізомерів істотно зростає.
Молекули ізомерних алканів різняться за послідовністю сполучення атомів Карбону. Ці сполуки є структурними
ізомерами і мають
різні властивості. Наприклад, температура кипіння бутану з нерозгалуженими молекулами становить –0,5 °С, а його
ізомеру з
розгалуженими молекулами –11,7 °С. Існують відмінності й у хімічних властивостях ізомерів.
Назви. Згідно із систематичною номенклатурою органічних
сполук, назви всіх алканів мають суфікс -ан. Для перших чотирьох сполук цього гомологічного ряду використовують
традиційні назви: метан, етан, пропан, бутан. Основу назв
решти алканів становлять іншомовні
числівники (грецькі, латинські), які вказують на кількість атомів Карбону в молекулах:
С5Н12 — пентан, С6Н14 — гексан, С7Н16
— гептан, С8Н18 — октан, С9Н20
— нонан, С10Н22 — декан.
Якщо молекула має нерозгалужену («нормальну») будову, то перед назвою
алкану часто записують
літеру н із дефісом. Наприклад, сполуку з формулою СН3–СН2–СН2–СН3 називають н-бутаном.
Ізомер, формула якого

 ,
,
отримав назву «ізобутан».
Таблиця
Алкани

При складанні назв ізомерів використовують поняття «замісник». Замісник
— атом або група атомів (крім атома
Гідрогену), що є
відгалуженням у карбоновому ланцюзі. Загальне
позначення замісника — R.
Якщо замісник утворений з атомів Карбону і Гідрогену, його називають вуглеводневим залишком. Формулу такого замісника можна отримати, «вилучивши» один атом Гідрогену з формули
вуглеводню. Назва замісника походить від назви вуглеводню і має суфікс -ил (-іл):
метил СН3–,
етил СН3–СН2–,
пропіл СН3–СН2–СН2–.
Загальна формула цих та інших аналогічних замісників СnН2n+1–.
Замісником, наявним у молекулі ізобутану, є група атомів СН3–, а
молекула
містить три замісники — групу атомів С2Н5– (етил), групу СН3–(метил) та групу С3Н7–(ізопропіл).
Існують правила і рекомендації щодо складання систематичних назв алканів із
розгалуженим карбоновим ланцюгом у молекулах.
Правила складання назв алканів розгалуженої
будови:
1. У молекулі алкану обирають найдовший (головний) карбоновий ланцюг і
нумерують у ньому атоми Карбону. Нумерацію починають із того кінця ланцюга, до якого ближче
перебуває замісник
(замісники).
2. Визначають назву кожного замісника.
3. Назви замісників розміщують за алфавітом (відповідно до українського
правопису) на
початку назви сполуки.
Перед назвою кожного замісника через дефіс указують номер атома Карбону, з яким
сполучений замісник. Останньою
записують назву алкану нерозгалуженої будови, молекула якого містить стільки атомів Карбону, скільки
їх у головному
ланцюзі.
4. За наявності кількох однакових замісників зазначають їх кількість, додаючи до назви
замісника префікс (ди- або ді-, три-, тетра- тощо), а перед ним указують
номери відповідних атомів
Карбону, розділені комами.
Згідно з наведеними правилами, систематична назва вуглеводню, структурна
формула молекули
якого

4-Метилгексан.
Замісниками в молекулах органічних сполук можуть бути
атоми галогенів — F, Cl, Br, I.
Приклади назв і формул таких сполук: йодометан CH3I,
дибромометан CH2Br2 тощо.
У молекулах алканів атоми Карбону з’єднані з різною
кількістю атомів цього елемента. Якщо атом Карбону сполучений з одним таким самим атомом, його називають первинним, якщо із двома — вторинним,
із трьома або чотирма — третинним і четвертинним
відповідно:
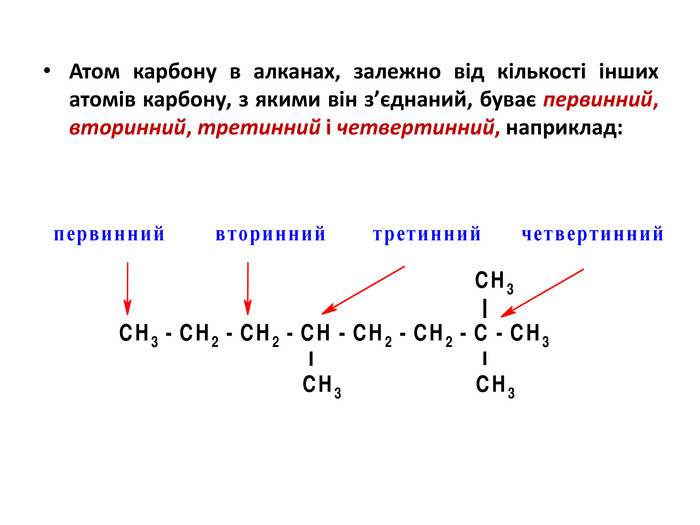
У нерозгалуженому карбоновому ланцюзі містяться лише
первинні (на його кінцях) і вторинні атоми Карбону.
Насичені вуглеводні з відкритим карбоновим ланцюгом у молекулах називають алканами. Їх загальна формула — СnH2n+2.
Майже для всіх алканів існують структурні ізомери; їх молекули мають різну будову карбонового
ланцюга.
Назви алканів містять суфікс -ан.
Для перших чотирьох сполук гомологічного ряду використовують
традиційні назви: метан, етан, пропан, бутан.
Основу назв решти алканів становлять іншомовні
числівники.
Алкани з молекулами розгалуженої будови називають за правилами систематичної номенклатури.
Завдання:
27. Серед наведених формул укажіть ті, що належать
алканам: СН4, С3Н6, С6Н12,
С7Н16, С8Н18.
28. Назвіть алкани, які не мають ізомерів.
29. Складіть структурні формули молекул алканів, що
мають такі назви:
а) 3-метилгексан;
б) 3,4-діетилгептан;
в) 3-етил-2-метилгептан.
30. Зобразіть структурні формули молекул усіх
ізомерних алканів С5Н12 і назвіть сполуки.
33. Які вуглеводні в поданому переліку є ізомерами: 3-етил-2-метилпентан; 2,2,3-триметилпентан; 3,3-діетилпентан?
34. Обчисліть густину бутану (за н. у.) і його
відносну густину за воднем.
35. Складіть структурну формулу алкану із четвертинним
атомом Карбону в молекулі, якщо молярна маса сполуки становить 72 г/моль.
Властивості
алканів
Фізичні властивості. Алкани з невеликою кількістю атомів
Карбону в молекулах за звичайних умов (температура +20 °С і тиск 760 мм рт. ст.) є газами. Це — метан, етан, пропан,
бутан, ізобутан і диметилпропан. Алкани з молекулами
нерозгалуженої будови, що містять від 5 до 16 атомів Карбону, — рідини, решта — тверді речовини. Сумішшю твердих алканів СnH2n+2 (n ≥ 18) є парафін.
Алкани — безбарвні, а у твердому стані — білі речовини. Запах мають лише рідкі алкани; його називають «бензиновим».
Температури плавлення і кипіння алканів зі збільшенням кількості атомів Карбону в молекулах зростають.
За нормального тиску метан СН4 плавиться і закипає за температур –182,5 і –161,6 °С, н-бутан
С4Н10 — за –138,3 і –0,5 °С, а н-октан С8Н18
— за –56,8 і +125,7 °С.
Залежність температур кипіння алканів від їх молекулярної маси пояснюють так. Чим важча молекула, тим більшу енергію їй потрібно надати (тобто
нагріти речовину до вищої температури), щоб частинка залишила рідину (речовина при цьому переходить у газоподібний стан).
Алкани легші за воду. Оскільки молекули алканів неполярні, ці сполуки розчиняються в органічних
розчинниках, але нерозчинні у воді.
Хімічні властивості. Усі алкани є хімічно пасивними
сполуками. За певних умов вони вступають у реакції заміщення, розкладаються,
перетворюються на ізомери. Алкани — горючі речовини.
Реакції заміщення. При освітленні або за підвищеної температури
(250—400 °С) алкани взаємодіють із
хлором або бромом. Під час таких реакцій атоми Гідрогену в молекулах вуглеводнів заміщуються на атоми галогенів.
Взаємодію органічної сполуки з галогеном називають реакцією галогенування.
У реакції метану з хлором спочатку утворюється
хлорометан
hν або t
СН4 + Сl2 ⎯⎯⎯→ CH3Cl + НCl ,
потім — дихлорометан
hν або t
СН3Сl + Сl2 ⎯⎯⎯→ CH2Cl2 + НCl.
Процес може відбуватися до повного заміщення атомів
Гідрогену. Тому хлорування метану часто ілюструють
схемою
+Cl2 +Cl2 +Cl2 +Cl2
CH4 ⎯⎯→ CH3Cl ⎯⎯→ CH2Cl2 ⎯⎯→ CHCl3 ⎯⎯→ CCl4.
–HCl –HCl –HCl –HCl
метан хлорометан дихлоро- трихлоро- тетрахлорометан
метан метан
У цій схемі над кожною стрілкою вказано формулу реагенту (зі знаком «плюс»), а під стрілкою —
формулу «другорядного» продукту реакції — хлороводню (зі знаком «мінус»).
Термічний розклад. При сильному нагріванні за відсутності повітря (кисню)
алкани розкладаються. Під час таких реакцій утворюються
насичені й ненасичені вуглеводні, а також водень:
СН3–СН2–СН2–СН3
→ СН3–СН3 + СН2=СН2;
1500 °С
2СН4 ⎯⎯⎯→ НС≡СН + 3Н2.
Ізомеризація. За певних умов алкани нерозгалуженої будови перетворюються на ізомери з розгалуженим карбоновим ланцюгом у молекулах:
н-бутан → ізобутан.
Реакції, під час яких
утворюються ізомери вихідних сполук унаслідок перегрупування атомів у молекулах,
називають реакціями ізомеризації.
Реакції окиснення. Алкани при підпалюванні горять з утворенням
вуглекислого газу і водяної пари; при цьому виділяється велика кількість теплоти:
СН4 + 2О2 → СО2 + 2Н2О; ΔН = –803 кДж.
Якщо повітря (кисню) не вистачає, то серед продуктів реакції з’являються чадний газ і вуглець.
Суміші метану, інших газуватих алканів, а також пари рідких алканів із повітрям є вибухонебезпечними. Користуючись
природним газом, слід бути дуже обережними. Вибух може статися вже за об’ємної частки метану в повітрі 5 %. Потрібно також
пам’ятати, що газ, витікаючи через пошкоджений вентиль побутової плити,
може спричинити отруєння.
ВИСНОВКИ
Найпростіші алкани за звичайних умов є газами, інші — рідинами або твердими речовинами. Рідкі
алкани мають характерний запах.
Алкани розчиняються в органічних розчинниках.
Температури плавлення
і кипіння цих сполук зі збільшенням їх відносної молекулярної маси зростають.
Усі алкани хімічно пасивні. За певних умов вони вступають у реакції заміщення, при нагріванні без
доступу повітря розкладаються чи перетворюються
на ізомери. Алкани — горючі речовини.
Завдання:
36. Як впливає склад молекул алканів на їхні фізичні
властивості?
37. За значеннями температур кипіння метану, етану,
пропану та н-бутану,
наведеними в параграфі та знайденими вами в інтернеті, побудуйте графік залежності цієї фізичної властивості алканів від молярної маси сполуки. Прокоментуйте графік.
38. Напишіть рівняння реакцій, що відбуваються при
бромуванні етану.
39. Допишіть хімічні рівняння:
а) ... + 11О2 → 7СО2 + ...H2O;
б) C3H8 → CH4 + ... .
40. Який об’єм кисню (н.
у.) потрібний для спалювання 10 л пентану, що має густину
0,626 г/см3?
41. При повному згорянні 1 моль пропану виділяється
2200 кДж теплоти, а 1 моль н-бутану — 2880 кДж. Складіть термохімічні рівняння реакцій горіння цих
сполук.
42. У балоні міститься 20 кг суміші пропану і бутану.
Масова частка пропану в суміші становить 22 %. Обчисліть середню
молярну масу суміші цих газів.
ДЛЯ ДОПИТЛИВИХ
Циклоалкани
Серед насичених вуглеводнів є велика група сполук із
молекулами циклічної будови. Їх називають циклоалканами. Вони в невеликій
кількості разом з іншими вуглеводнями містяться в нафті.
У цикл можуть сполучитися щонайменше три атоми Карбону.
Відомі циклоалкани з різною кількістю атомів Карбону,
об’єднаних у цикл, а також такі, молекули яких мають вуглеводневі
замісники.
Назва циклоалкану складається з назви алкану з такою
самою кількістю атомів Карбону в молекулі і префікса цикло-. Якщо в молекулі циклоалкану є замісник, то його назву вказують на початку назви сполуки. У разі наявності кількох замісників указують їх положення і назви.
Молекула циклоалкану містить на два атоми Гідрогену
менше, ніж молекула алкану з такою самою кількістю атомів
Карбону. Тому загальна формула циклоалканів — СnH2n
(n = 3, 4, ...). Згідно з нею масова частка
Карбону в будь-якому циклоалкані становить 85,7 %, а Гідрогену — 14,3 %.
Циклопропан і циклобутан за звичайних умов є газами,
інші циклоалкани — рідини або тверді речовини. Зі
збільшенням відносної молекулярної маси сполук їхні температури плавлення і
кипіння зростають. Циклоалкани, як і алкани, нерозчинні у
воді, але розчиняються в органічних розчинниках.
За хімічними властивостями циклоалкани подібні до
алканів. Для них характерні реакції заміщення.
Карбонові цикли в молекулах циклопропану і циклобутану
нестійкі й під час хімічних реакцій розкриваються. Продукти таких перетворень
складаються з молекул, які містять відкриті ланцюги з атомів Карбону.
Комментарии
Отправить комментарий