ПМ-18 Хімія
03.04.2020
Лекція (2 год.)
Тема 4.10. Основи. Властивості,
застосування гідроксидів
Натрію і Кальцію.
Опрацювати: Хімія 11 клас (за
посиланням «Підручники»), с.158-163, §26, лекційний матеріал.
1. Замалюйте у зошит схему «Класифікація
основ»
2. Випишіть рівняння
хімічних реакцій, що характеризують хімічні властивості основ.
3. Запишіть у зошит висновки.
4. З яким компонентом повітря може реагувати натрій
гідроксид, який міститься в негерметичній упаковці? Наведіть відповідне хімічне
рівняння.
5. Складіть молекулярне та йонно-молекулярне рівняння
реакції розчину лугу з алюміній гідроксидом, продуктом якої є натрій гексагідроксоалюмінат
Na3[Al(OH)6].
6. Чи взаємодіють кальцій гідроксид із барій нітратом,
натрій гідроксид із ферум(ІІ) сульфідом? Кожну відповідь обґрунтуйте.
7. Виконайте завдання для самоконтролю 1-34.
Склад
і назви основ.
Серед
кількох найважливіших класів неорганічних
сполук є клас основ.
Основи –
це сполуки, до складу яких входять атом металічного елемента й одна або
кілька гідроксильних груп OH (залежно від валентності металу).
Загальна
формула основ: Me(OH)n, де n – число груп OH, що
відповідає валентності металічного елемента. Me – символ металічного
елемента.
Назва основ
Назви основ,
як і неорганічних сполук інших класів,
складаються із двох слів. Першим є назва металічного елемента, а другим — слово
«гідроксид»: KOH – калій гідроксид, Ba(OH)2 – барій
гідроксид. Якщо елемент має кілька значень валентностей, то це значення
вказується у назві гідроксиду:
Fe(OH)2 – ферум(II) гідроксид, Fe(OH)3 – ферум(III) гідроксид.
Тривіальна назва
натрій гідроксиду — їдкий натр, а кальцій гідроксиду — гашене вапно. Іноді
натрій гідроксид називають каустичною содою (із грецької kaustikos — пекучий). Ba(OH)2 – баритова
вода; Ca(OH)2 – гашене вапно, вапняне молоко, вапняна вода; NH4OH – нашатирний
спирт.
Основи — йонні речовини; їхніми
складниками є катіони Меn+ і аніони ОН–.
Формули гідроксидів, які відповідають оснóвним
оксидам
Фізичні властивості основ
Усі основи — тверді речовини. Натрій гідроксид, який найчастіше
використовують у лабораторній практиці, має вигляд гранул або пластівців, а
кальцій гідроксид — білий порошок.
Більшість
основ не розчиняється у воді.
Гідроксиди
лужних елементів і Барію є розчинними, а сполуки Mg(OH)2 і Ca(OH)2
— малорозчинними. У 100 г води за температури 20 °С
розчиняється 112,4 г калій гідроксиду,
108,7 г натрій гідроксиду і лише 0,16 г кальцій гідроксиду.
Розчинні
основи, а також кальцій
гідроксид мають загальну назву «луги». Водний
розчин кальцій гідроксиду називають
вапняною водою.
Луги — сильні
електроліти. Розчиняючись у воді, вони
дисоціюють на йони, з яких складаються:
Вa(OH)2
= Вa2+ + 2OH–. Дисоціація відбувається в одну стадію, а
не у дві.
Розчинення
гідроксидів Натрію і Калію супроводжується
виділенням значної кількості теплоти. Ці сполуки добре поглинають вологу
і навіть розпливаються у вологій атмосфері.
Тому їх зберігають у щільно
закритих посудинах і використовують для осушування газів, багатьох органічних
рідин.
Луги та їхні
розчини роз’їдають тканини, папір, шкіру,
становлять небезпеку для слизових оболонок і особливо очей, спричиняють тяжкі
опіки. Працювати з ними потрібно дуже обережно.
При нагріванні основи не плавляться, а
розкладаються на відповідні оксиди і воду (винятки —
NaOH, KOH). Температура плавлення натрій гідроксиду становить +322 °С,
а калій
гідроксиду +405 °С. Кальцій
гідроксид зазнає
розкладу за температури 580 °С.
Класифікація основ
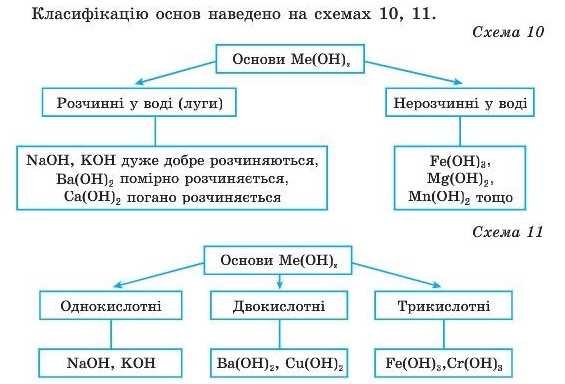
Хімічні
властивості.
1. Розчинні і нерозчинні основи мають спільну властивість – реагують з
кислотами, утворюючи сіль і воду:
NaOH + HCl = NaCl + H2O; Cu(OH)2 + 2HCl = CuCl2 + 2H2O. Тип реакції – обміну, нейтралізації.
Під час взаємодії багатооснóвних кислот з гідроксидами можуть утворюватися
кислі солі:
KOH + H2SO4 = KHSO4 + H2O; Ca(OH)2 + 2H2SO4 = Ca(HSO4)2 + 2H2O.
Під час взаємодії багатокислотних гідроксидів з однооснóвними кислотами
можуть утворюватися оснóвні солі:
Ca(OH)2 + HCl = CaOHCl + H2O (основа в надлишку); CaOHCl + HCl = CaCl2 + H2O. |
|||||||||||||||
2. Луги реагують з кислотними оксидами, утворюючи середню або кислу
сіль при надлишку чи нестачі лугу відповідно:
2NaOH + CO2 = Na2CO3 + H2O; NaOH + CO2 = NaНCO3. |
Для
нерозчинних основ такі реакції не характерні.
|
||||||||||||||
3 Луги
взаємодіють із розчинними солями малоактивних металічних
елементів, утворюючи нову сіль і нерозчинну основу:
2KOH + FeCl2 + Fe(OH)2↓ + 2KCl. Луги можуть взаємодіяти із розчинними солями активних металічних елементів, якщо в результаті реакції утворюється нерозчинна сіль: K2SO4 + Ba(OH)2 = 2KOH + BaSO4↓.
Луги
взаємодіють з кислими солями утворюючи середні солі: KHSO4 +
KOH = K2SO4 + H2O.
|
Для
нерозчинних основ такі реакції не характерні.
|
||||||||||||||
5. Майже
всі основи (крім гідроксидів Натрію і Калію, лужних металів) у результаті
нагрівання легко розкладаються на оксид і воду:
Cu(OH)2 = CuO + H2O. |
|||||||||||||||
Способи добування основ
Розчинних
|
Нерозчинних
|
Meакт +
H2O → MeOH + H2↑
(Meакт)xOy + H2O → Me(OH)n |
(Meм.акт)хRy + МеOH = MexRy +
Me(OH)n↓
|
Електроліз
розчинів солей: 2NaCl + 2H2O = H2 + Cl2 +
2NaOH
де Меакт. – активний метал, Мем.акт. – малоактивний метал. |
|
1. Розчинні
гідроксиди (луги) можна добути взаємодією активних металів та їх оксидів з
водою:
2Na + 2H2O = 2NaOH + H2↑;
Na2O + H2O = 2NaOH.
Na2O + H2O = 2NaOH.
2.
Взаємодією розчинів солей з лугами можна також використати для добування деяких
розчинних основ. Якщо на розчини солей натрію, літію та деяких інших металів
подіяти гідроксидом барію або кальцію, то внаслідок реакції утвориться розчинна
основа і нерозчинна сіль, яку можна легко відокремити від розчину:
Na2CO3 + Ca(OH)2 =
2NaOH + CaCO3↓;
Li2SO4 + Ba(OH)2 = 2LiOH + BaSO4↓.
Li2SO4 + Ba(OH)2 = 2LiOH + BaSO4↓.
3. Луги
можна добути електролізом водних розчинів солей.
4.
Нерозчинні гідроксиди можна добути реакцією обміну між сіллю (найчастіше сіллю
малоактивного металічного елемента) та лугом у розчині:
FeCl3 + 3NaOH = 3NaCl + Fe(OH)3↓.
Практичне застосування деяких основ
NaOH – у великій кількості використовується у нафтовій промисловості для очищення нафтопродуктів переробки нафти, в миловарній, паперовій, текстильній промисловостях, у виробництві штучного шовку та в ряді інших виробництв. Кип’ятінням деревини з NaOH добувають целюлозу. Обробка бавовняних тканин натрій гідроксидом поліпшує їх здатність до фарбування. Натрій гідроксид – важливий реактив
у аналітичній хімії.
КОН – застосовують у миловарній
промисловості для виготовлення рідкого мила. Внаслідок великої гігроскопічності
його використовують як осушувач, для вбирання вуглекислого газу, у хірургії для
припікання, як вихідний продукт для добування різних солей калію.
Ca(OH)2 – відомий під
назвою «гашене вапно», широко використовують у будівництві. Суміш гашеного
вапна з піском і водою називають вапняним розчином і
використовують для скріплення цегли під час мурування цегляних стін, а також як
штукатурка. Вапняний розчин твердне спочатку внаслідок випаровування води, а
потім – внаслідок вбирання гашеним вапном з повітря вуглекислого газу й
утворення кальцій карбонату. Ca(OH)2 використовують для
добування хлорного вапна [Са(ОН)2 + Сl2 → CaOCl2 +
H2O]. Як «вапняну воду» застосовують для білення, у медицині проти
опіків або як протиотруту при отруєннях сульфатною чи оксалатною кислотами.
Ba(OH)2 – насичений водний розчин
відомий як «баритова вода», є важливим лабораторним реактивом для виявлення СО2,
йонів SO42– та СO32– та
відносно дешевою розчинною основою.
NH4OH
– один з
найважливіших хімічних реактивів, розбавлений розчин якого «нашатирний спирт»
застосовують як слабку основу в хімічній практиці, у медицині, домашньому
господарстві.
Висновки:
Основи — сполуки, які складаються з катіонів
металічних елементів і аніонів ОН–. Загальна формула основ — Ме(ОН)n.
Розрізняють розчинні у воді основи (луги) й нерозчинні основи.
Луги взаємодіють з кислотними й амфотерними
оксидами, кислотами, амфотерними гідроксидами, а
їх розчини — ще й із солями.
Найважливішими лугами є натрій гідроксид і кальцій гідроксид. Ці сполуки використовують у
хімічній промисловості, техніці, інших сферах.
Нерозчинні у воді основи розкладаються при нагріванні.
Завдання для самоконтролю:
1. Якщо на
одяг або шкіру потрапляє їдка речовина, то її необхідно змити: а) водою; б)
водою, а потім нейтралізуючою речовиною; в) витерти.
2. Виберіть
формули тих речовин, які можна віднести до гідроксидів: MgO, Ca, NaOH, Fe2O3,
Cu(OH)2, H2SO4, CO2, Fe(OH)3.
Назвіть їх.
3. Напишіть
формули гідроксидів, які відповідають таким оксидам: Li2O, Fe2O3,
MnO, CaO, PbO, Na2O, Cu2O, Al2O3.
Назвіть їх.
4. Складіть
формули основ, утворених такими елементами: Літій, Барій, Калій, Алюміній,
Купрум(I), Нікол(II), Кальцій. Назвіть їх.
5. Визначте
формулу гідроксиду, відносна молекулярна маса якого 107, а валентність
металічного елемента – III.
6. Визначте
формулу гідроксиду, відносна молекулярна маса якого 40, а валентність
металічного елемента – I.
7. Назвіть
речовини, формули яких: KOH, K2O, NaOH, Na2O.
8. Вкажіть
розчинну у воді основу: NaOH, Pb(OH)2, Mg(OH)2.
9. З
переліку наведених речовин Al(OH)3, BaSO4, Cu(OH)2,
KOH, KCl, LiOH, Ba(OH)2, Fe2O3, Fe(OH)3. Випишіть
формули: а) нерозчинних основ; б) розчинних основ.
10. В присутності
фенолфталеїну луги змінюють свій колір на: а) малиновий; б) синій; в) змін не
спостерігається.
11. Вкажіть
відповідність:
1. гашене
вапно;
|
а) Ва(OH)2;
|
2.
каустична сода;
|
б) Cа(OH)2;
|
3.
баритова вода;
|
в) NaOH.
|
12. Напишіть
формули оксидів, які відповідають таким гідроксидам: Fe(OH)2, NaOH,
Cr(OH)3, Pb(OH)2, Mg(OH)2. Назвіть їх.
13. Складіть
формули таких гідроксидів: хром(II) гідроксид; літій гідроксид; цинк гідроксид;
кальцій гідроксид; калій гідроксид.
14. Обчисліть
кількість речовини кальцій гідроксиду масою 10,2 г.
15. Визначте
масу алюміній гідроксиду кількістю речовини 0,3 моль.
16. Складіть
формули і вкажіть характер оксидів і гідроксидів таких елементів: карбон(IV)
оксид, цинк оксид, фосфор(V) оксид, плюмбум(ІV) оксид, берилій оксид.
17. Визначте
формулу гідроксиду, відносна молекулярна маса якого 241, а валентність
металічного елемента – II.
18. Визначте
формулу гідроксиду, відносна молекулярна маса якого 56, а валентність
металічного елемента – I.
19. Напишіть рівняння реакцій,
характерні для КОН та Fe(OH)2.
20. Закінчіть рівняння реакцій, які
відображають хімічні властивості основ і спосіб їх добування:
а) KOH + HCl → … д) Zn(OH)2 + HCl → …
б) KOH + CO2 → … е) Zn(OH)2 …
…
в) KOH + FeCl2 → … є) CaO + H2O → …
г) K + H2O → … ж) CuCl2 + KOH → …
а) KOH + HCl → … д) Zn(OH)2 + HCl → …
б) KOH + CO2 → … е) Zn(OH)2
в) KOH + FeCl2 → … є) CaO + H2O → …
г) K + H2O → … ж) CuCl2 + KOH → …
21. Зобразіть хімічними рівняннями
такі процеси: а) реакція натрій гідроксиду з фосфор(V) оксидом; б)
нейтралізація ферум(III) гідроксиду нітратною кислотою; в) розкладання алюміній
гідроксиду; г) взаємодія кальцій гідроксиду з карбон(IV) оксидом.
22. Які з поданих речовин можна
використати для нейтралізації сульфатної кислоти? Na2CO3,
KOH, H2O, Ba(OH)2, CuO, Pb(OH)2, Cu, BaCl2,
Al(OH)3. Напишіть рівняння можливих реакцій.
23. Напишіть різнотипні рівняння добування таких основ: а) KOH; б) Zn(OH)2;
в) Fe(OH)2; г) Cu(OH)2.
24. Як відрізнити однакові за зовнішнім виглядом білі осади Al(OH)3 і Mg(OH)2?
25. Який ряд формул, утворений лише з
формул основ:
а) KOH, KCl, K2O; б) NaOH, Fe(OH)2, KOH?
а) KOH, KCl, K2O; б) NaOH, Fe(OH)2, KOH?
26. Назвіть речовину, формула якої Al(OH)3:
а) алюміній оксид;
б) алюміній гідроксид; в) алюміній нітрат.
б) алюміній гідроксид; в) алюміній нітрат.
27. Вкажіть рівняння реакції розкладу:
а) C + O2 = CO2; б) Zn(OH)2 = ZnO + H2O; в) 2HCl + Zn = ZnCl2 + H2O.
28. Визначте масову частку металу в:
а) NaOH; б) Zn(OH)2.
29. Закінчіть рівняння реакції, в
результаті якої утворюється купрум(II) сульфат: а) Cu + H2SO4 → …;
б) CuCl2 + SO2 → …; в) Cu(OH)2 +
H2SO4 →
30. Закінчіть рівняння реакцій.
Визначте рівняння реакції нейтралізації: а) Al(OH)3 + HCl → …;
б) KOH + CO2 → …; в) Mg(OH)2 + HNO3 →
…; г) KOH + SO3 → …; д) LiOH + H2SO4 →
…; е) KOH + SO2 → …; є) KOH + FeCl2 → …; ж)
Ba(OH)2 + P2O5 → …
31. Закінчіть рівняння реакції
нейтралізації: а) ? + HCl = AlCl3 + ?; б) Mg(OH)2+
? = MgSO4 + ?; в) ? + ? = Pb(NO3)2 + ?
32. Які речовини утворяться при нагріванні:
а) Al(OH)3;
б) Fe(OH)2;
в) Fe(OH)3;
г) Cu(OH)2?
33. Здійсніть перетворення: а) Mg →
MgO → Mg(OH)2 → MgCl2; б) S → SO2 →
H2SO3 → K2SO3.
34. Який об’єм сульфур(IV) оксиду (н.
у.) може поглинути розчин калій гідроксиду, що містить 5,6 г лугу?
Комментарии
Отправить комментарий